
【题目】苯和液溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。填写下列空白:

(1)试管C中苯的作用是:____________________。反应开始后,观察D和E两试管,看到的现象为:D____________________;E____________________。
(2)反应2—3min后,在B中的NaOH溶液里可观察到的现象是____________________。
(3)在上述整套装置中,具有防倒吸的仪器有____________________(填字母)。
【答案】除去HBr气体中混有的溴蒸气 D试管中紫色石蕊试液慢慢变红,并在导管口有白雾产生 E试管中出现浅黄色沉淀 在溶液底部有无色油状液体 D、E、F
【解析】
(1)苯和液溴在Fe作催化剂时发生取代反应产生溴苯和HBr,由于溴单质溶液挥发产生溴蒸汽会干扰HBr的检验,所以在检验之前应该除去。
试管C中苯的作用是:除去HBr气体中混有的溴蒸气;
HBr的水溶液显酸性, HBr遇水蒸气形成氢溴酸的小液滴而产生白雾;HBr与AgNO3会发生沉淀反应而形成浅黄色沉淀。所以反应开始后,观察D和E两试管,看到的现象为:D试管中紫色石蕊试液慢慢变红,并在导管口有白雾产生,E试管中出现浅黄色沉淀。
(2)反应2~3 min后,由于产生的溴苯是液态物质,不容易溶于水,密度比水大,NaOH溶液可以除去产物混有的溴,故在B中的NaOH溶液里可观察到的现象是在溶液底部有无色油状液体;
(3)在上述整套装置中,具有防倒吸的仪器有D、E、F。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A. 标准状况下,11.2L的己烷所含的分子数为0.5NA
B. 28g乙烯所含共用电子对数目为4NA
C. 1mol羟基所含电子数为7 NA
D. 现有乙烯、丙烯的混合气体共14g,其原子数为3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物甲有镇咳、镇静的功效,其合成路线如下:
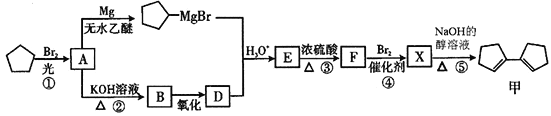
已知: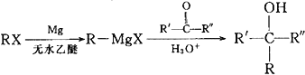 (R、R'、R"代表烃基或氢)
(R、R'、R"代表烃基或氢)
(1)有机物甲的分子式为___________,有机物A中含有的官能团的名称为_______________。
(2)有机物B的名称是__________,由B→D 所需的反应试剂和反应条件为________________。
(3)在上述①~⑤反应中,属于取代反应的有____________(填序号)。
(4)写出E→F的化学方程式________________。
(5)满足“属于芳香族化合物”的甲的同分异构体有________种。其中核磁共振氢谱上只有2组峰的结构简式是______________
(6)根据题给信息,写出以CH4为原料制备CH3CHO的合成路线(其他试剂任选)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较硫与氯元素非金属性强弱的是____________(填标号)。
A.将Cl2通入Na2S溶液中,有黄色浑浊出现 B.比较次氯酸和硫酸的酸性强弱
C.氯气与铁反应生成氯化铁,硫和铁反应生成硫化亚铁 D.还原性:H2S>HCl
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制备氢气的热化学方程式分别为___________、_______,制得等量H2所需能量较少的是_______。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率α1=______%,反应平衡常数K=_____。(可用分数表示)
②在620 K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率α2_________α1,该反应的△H___0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是____________ (填标号)
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D、E、F为周期表中前四周期的七种元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同。
请回答下列问题:
(1)D元素的原子中存在________种运动状态的电子;
(2)在A元素与上述其他元素形成的分子中,其中心原子为sp3杂化的为________(写出2种即可)
(3)与C同族且位于第四周期元素所形成简单气态氢化物的电子式为________;其与C的简单气态氢化物相比稳定性更________(填“强”或“弱”);
(4)F的基态原子核外电子排布式是_____________________________;其在元素周期表中的位置是:_______________________________;
(5)E原子的第一电离能比同周期后面相邻元素的第一电离能________(填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用SCR技术可有效降低柴油发动机NOx排放。SCR工作原理为尿素[CO(NH2)2]水溶液热分解为NH3和CO2,再利用NH3转化NOx,装置如图所示:

下列说法不正确的是( )
A. 尿素水溶液热分解反应不属于氧化还原反应
B. 转化器工作过程中,当转移0.6mol电子时,会消耗4.48L NH3
C. 该装置转化NO时,还原剂与氧化剂物质的量之比为2:3
D. 转化NO2过程的化学方程式为:8NH3+6NO2![]() 2N2+12H2O
2N2+12H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节日燃放的烟花利用了“焰色反应”的原理。下列说法中正确的是( )
A.焰色反应属于化学变化
B.NaCl与Na2CO3灼烧时火焰颜色相同
C.某样品的焰色颜色为黄色,则该样品仅含有钠元素
D.焰色反应时金属丝应用硫酸清洗并在外焰上灼烧至没有颜色,再蘸取样品灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,请回答下列问题:

(1)若在原电池中,a电极有气泡产生,b电极逐渐变细,则该原电池的正极是___(填写字母“a”或“b”),外电路中电流流动的方向是___,b电极发生的反应类型是____(填“氧化反应”或“还原反应”)。
(2)当电极a为Zn、电极b为Ag、电解质溶液为CuSO4时,写出该原电池总的离子反应方程式:____,正极的电极反应式为____。当a极溶解的质量为6.5g时,有_____mol电子通过导线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中一定能大量共存的是
A. 能使甲基橙变红的溶液:Na+、NH4+、NO3-、CO32-
B. 加入苯酚显紫色的溶液:K+、NH4+、Cl-、SCN-
C. 常温下,![]() =1×10-14的溶液:K+、Na+、AlO2-、CO32-
=1×10-14的溶液:K+、Na+、AlO2-、CO32-
D. 加入Al能放出大量H2的溶液:Na+、Fe2+、NO3-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com