
回答以下问题:
(1)Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测Ni(CO)4是____________分子(填“极性”或“非极性”)。
(2)已知:波长为300nm的紫外光的光子所具有的
能量约为39 9 kJ/mol。
根据右表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:______________________________________________________________
_____________________________________________________________。
|
共价键 |
C-C |
C-N |
C-S |
|
键能/ kJ·mol-1 |
347 |
305 |
259 |
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中含有极性键的数目是___________ ;NH4+的空间构型是_______________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该 反应中有8mol N-H键断裂,则形成的π键有________mol。
(4)硼砂是含结晶水的四硼酸钠,其阴离子 (含B、O、H三种元素)的球棍模型如图所示:
(含B、O、H三种元素)的球棍模型如图所示:

①在 中,硼原子轨道的杂化类型有 和________;配位键存在于 原子之间(填原子的数字标号);m= (填数字)。
中,硼原子轨道的杂化类型有 和________;配位键存在于 原子之间(填原子的数字标号);m= (填数字)。
②硼砂晶体由 、
、 和
和 构成,它们之间存在的作用力有 (填序号)。
构成,它们之间存在的作用力有 (填序号)。
A.共价键 B.离子键 C. 氢键 D.范德华力 E. 金属键
(1)非极性(1分)
(2)紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子 (2分)
(3)①4(1分) 正四面体 (1分)② 6mol(1分)
(4)①SP2杂化 (1分) SP3杂化(1分) 4、5(1分),m=2(1分) ②B C D(2分,漏选得1分,有错选不得分)
【解析】
试题分析:(1)Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂,因为水为极性溶剂,而有机溶剂为非极性溶剂,根据相似相溶的原理可以知道其为非极性分子;(2)波长为300nm的紫外光的光子所具有的能量约为39 9 kJ/mol,而蛋白质中各种键的键能都比该能量小,所以人体长时间照射紫外光后皮肤易受伤害的原因为:紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子;(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。①N2H4分子中含有极性键的数目是4个,而非极性键为1个,NH4+的空间构型是正四面体;②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1,若该反应中有8mol N-H键断裂,说明有2mol的肼反应,则生成3mol氮气,一个氮气含有两个π,则形成的π键有6mol,(4)①1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为SP2杂化,4号B形成4个键,则B原子为SP3杂化; B一般是形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在4号与5号之间.观察模型,可知Xm-是(H4B4O9)m-,依据化合价H为+1,B为+3,O为-2,可得m=2,②钠离子与Xm-形成离子键,结晶水分子间存在氢键和范德华力,故答案为:BCD。
考点:极性分子与非极性分子、分子空间构型、杂化类型、分子间作用力
点评:本题考查了极性分子与非极性分子、分子空间构型、杂化类型、分子间作用力,这些考点是高考考查的重点和难点,本题综合性强,难点较大。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:





查看答案和解析>>
科目:高中化学 来源: 题型:
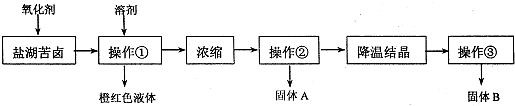
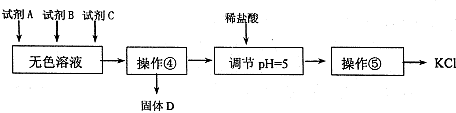
查看答案和解析>>
科目:高中化学 来源: 题型:
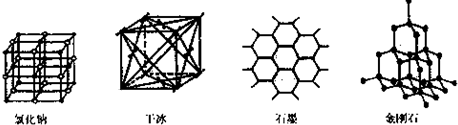
查看答案和解析>>
科目:高中化学 来源: 题型:

 +RX
+RX| 催化剂 |
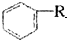 +HX(R.是烃基,X为卤原子)
+HX(R.是烃基,X为卤原子)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com