
| 1.08g |
| 108g/mol |


科目:高中化学 来源:不详 题型:单选题
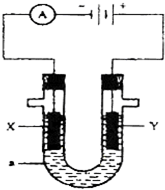
| A.a为正极,b为负极;NaClO和NaCl |
| B.a为负极,b为正极;NaClO和NaCl |
| C.a为阳极,b为阴极;HClO和NaCl |
| D.a为阴极,b为阳极;HClO和NaCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碳酸镁 | B.硫酸钡 | C.氢氧化镁 | D.碳酸钡 |
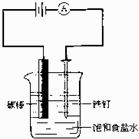
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
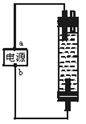
| A.电解池的阳极上发生氧化反应,阴极上发生还原反应 |
| B.原电池跟电解池连接后,电子从电池负极流向电解池阳极 |
| C.电镀时,电镀池里的阳极材料发生氧化反应 |
| D.电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.KNO3 | B.NaCl | C.AgNO3 | D.CuCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液的pH不变 |
| B.溶液中H2SO4的物质的量不变 |
| C.水的质量不变 |
| D.溶液的质量不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.25mol?L-1 | B.0.8mol?L-1 |
| C.1.0mol?L-1 | D.1.2mol?L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com