
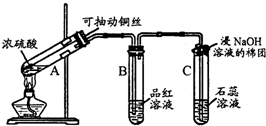
分析 (1)A中浓硫酸与铜在加热条件下生成硫酸铜、二氧化硫和水;C试管口二氧化硫与过量氢氧化钠反应生成亚硫酸钠和水;
(2)二氧化硫具有漂白性,能够使品红溶液褪色,二氧化硫漂白性具有不稳定性;酸性氧化物与水反应生成对应酸,酸能够使石蕊变红色.
解答 解:(1)A中浓硫酸与铜在加热条件下生成硫酸铜、二氧化硫和水,化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
C试管口二氧化硫与过量氢氧化钠反应生成亚硫酸钠和水,离子方程式:SO2+2OH-=SO32-+H2O;
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;SO2+2OH-=SO32-+H2O;
(2)浓硫酸与铜反应生成二氧化硫,二氧化硫具有漂白性,能够使品红溶液褪色,二氧化硫漂白性具有不稳定性,所以若将该试管B中反应后的溶液加热,可以观察到试管B中的实验现象是:褪色后的品红溶液变红;二氧化硫与水反应生成亚硫酸,亚硫酸具有酸性,能够使石蕊变红色,可证明二氧化硫为酸性氧化物;
故答案为:品红溶液褪色;褪色后的品红溶液变红;酸性.
点评 本题考查了铜与浓硫酸反应的实验及产物验证,明确反应实质及产物的性质是解题关键,注意二氧化硫漂白性特点及酸性氧化物的性质,题目难度不大.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
下列情况一定属于化学变化的是
①胆矾晶体在空气中失水风化 ②导电 ③燃烧 ④煤的干馏 ⑤白磷转变成红磷 ⑥工业制氧气 ⑦久置氯水变成无色 ⑧分馏 ⑨NO2气体冷却后颜色变浅 ⑩氢氧化铁胶体加入硫酸钠有沉淀生成
A.①②③④⑦ B.③④⑤⑦⑩ C.①③④⑤⑦⑨ D.①③④⑦⑩
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH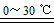 2K2FeO4+6KCl+8H2O。下列有关该反应说法正确的是
2K2FeO4+6KCl+8H2O。下列有关该反应说法正确的是
A.该反应是置换反应 B.钾元素化合价降低
C.Fe(OH)3发生氧化反应 D.Cl2是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校化学组的同学用如图装置对铜与浓硫酸在一定条件下的反应进行实验探究,请回答:
某校化学组的同学用如图装置对铜与浓硫酸在一定条件下的反应进行实验探究,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜与浓硫酸反应生成的白色固体是CuSO4 | |
| B. | ①中灰白色固体不可能含有CuO | |
| C. | ②中的黑色固体可能含有CuS或Cu2S | |
| D. | ④中所得的白色沉淀是BaSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
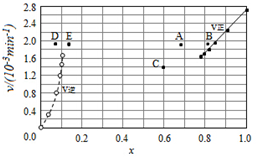 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
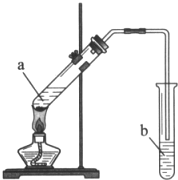 实验室用如图所示装置制备乙酸乙酯.
实验室用如图所示装置制备乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K=$\frac{{c}^{4}(C){c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$ | |
| B. | 增加B,平衡向右移动,B的平衡转化率增大 | |
| C. | 增大该体系的压强,平衡向左移动,化学平衡常数不变 | |
| D. | 此时B的平衡转化率是40% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com