
 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | C2H6、C4H8 | B. | C2H6、C3H6 | C. | CH4、C4H8 | D. | CH4、C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的综合利用主要是煤的干馏、液化和气化,气化是指:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 | |
| B. | 高温结构陶瓷氮化硅(Si3N4),属于新型无机非金属材料,可用于制造汽车发动机 | |
| C. | 用铝质铆钉来焊接铁板,铁板易被腐蚀 | |
| D. | 用铜、稀硫酸、过氧化氢混合制硫酸铜法体现了“绿色化学”的思想 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同体积、同浓度的NaF和NaCl溶液中,所有离子总数,N(NaCl)>N(NaF);同体积同浓度的Na2CO3和Na2SO4溶液中,所有离子总数,N(Na2CO3)>N(Na2SO4) | |||||||||||
| B. | 以下是某温度下高氯酸、硫酸、硝酸和盐酸在冰醋酸中的电离常数,则在冰醋酸中硫酸的电离方程式可表示为H2SO4?2H++SO42-
| |||||||||||
| C. | 已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中,[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)] | |||||||||||
| D. | 平衡体系CaCO3(s)?CaO(s)+CO2中仅含有碳酸钙、氧化钙及二氧化碳气体.某时刻,保持温度不变,将容器体积缩小为原来的一半并保持不变,则二氧化碳浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中氧化剂是CO、还原剂是NO2 | |
| B. | 该反应是氧化还原反应 | |
| C. | 该反应生成28 g N2时,转移8 mol e- | |
| D. | 该反应能减少汽车尾气对环境的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光}{→}$ CH3Cl+HCl | |
| B. | CH3CH2OH+CH3COOH $→_{△}^{浓硫酸}$ CH3COOCH2CH3+H2O | |
| C. | H2C=CH2+HCl→H2C-CH2Cl | |
| D. | 2CH3CH2OH+O2 $→_{△}^{Cu}$ 2CH3CHO+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
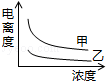 B.
B. C.
C.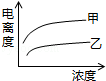 D.
D.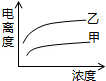
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO(g)═C(s)+$\frac{1}{2}$O2(g) | B. | 2N2O5(g)═4NO2(g)+O2(g) | ||
| C. | (NH4)2CO3(s)═NH4HCO3(s)+NH3(g) | D. | MgCO3(s)═MgO(s)+CO2(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com