
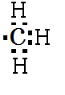 ;
;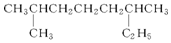 系统命名:2,6二甲基辛烷;
系统命名:2,6二甲基辛烷;分析 (1)甲烷去掉一个氢原子剩余部分为甲基,1个甲基含有9个电子;
(2)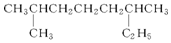 主链有8个电子的烷烃,2,6号碳上各有1个甲基;
主链有8个电子的烷烃,2,6号碳上各有1个甲基;
(3)设烷烃的分子式为CxH(2x+2),根据相对分子质量为72,列出方程式进行计算x值,支链越多,沸点越低;
(4)先书写戊基-C5H11异构体,戊基异构数目等于戊醇的异构体数目;能被氧化成醛必须是与羟基相连的碳原子上含有至少2个氢原子.不能发生催化氧化必须是与羟基相连的碳原子上没有氢原子.
解答 解:甲烷去掉一个氢原子剩余部分为甲基,1个甲基含有9个电子,碳原子与3个氢原子各共用1对电子,电子式: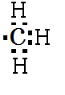 ;
;
故答案为: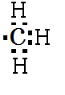 ;
;
(2)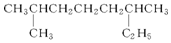 主链有8个电子的烷烃,2,6号碳上各有1个甲基,系统命名为:2,6二甲基辛烷;
主链有8个电子的烷烃,2,6号碳上各有1个甲基,系统命名为:2,6二甲基辛烷;
故答案为:2,6二甲基辛烷;
(3)设烷烃的分子式为CxH(2x+2),
则14x+2=72,解得x=5,
所以该烷烃的分子式为C5H12,
分子式为C5H12的同分异构体有主链有5个碳原子的:CH3CH2CH2CH2CH3,
主链有4个碳原子的:CH3CH(CH3)CH2CH3,
主链有3个碳原子的:CH3C(CH3)2CH3;
支链越多,沸点越低,故CH3C(CH3)2CH3,
故答案为:CH3C(CH3)2CH3.
(4)戊基-C5H11可能的结构有:-CH2CH2CH2CH2CH3、-CH(CH3)CH2CH2CH3、-CH(CH2CH3)2、-CHCH(CH3)CH2CH3、-C(CH3)2CH2CH3、-CH(CH3)CH(CH3)2、-CH2CH2CH(CH3)2、-CH2C(CH3)3,则戊醇的可能结构有8种;能被氧化成醛必须是与羟基相连的碳原子上含有至少2个氢原子,结构简式分别是:CH3CH2CH2CH2CH2OH、CH3CH2CH(CH3)CH2OH、CH3CH(CH3)CH2CH2OH、CH3C(CH3)2CH2OH,共4种;不能发生催化氧化必须是与羟基相连的碳原子上没有氢原子,结构简式为:HOC(CH3)2CH2CH3;
故答案为:HOC(CH3)2CH2CH3.
点评 本题考查化学用语的使用,明确电子式、结构简式、烷烃系统命名及同分异构体书写方法是解题关键,注意醇的催化氧化原理,综合性较强,难度中等.


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  利用图所示装置检验溴乙烷发生消去反应,生成乙烯 | |
| B. |  利用图所示装置配置银氨溶液 | |
| C. | 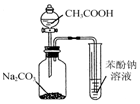 利用图所示装置证明H2CO3酸性强于苯酚 | |
| D. | 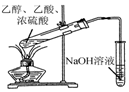 利用图所示装置制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
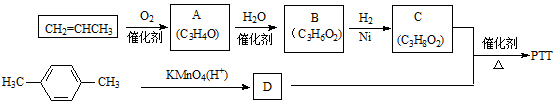

 ,反应类型为
,反应类型为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应H2(g)+Br2(g)?2HBr(g)△H<0.当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )
在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应H2(g)+Br2(g)?2HBr(g)△H<0.当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )| A. | 若b、c两点的平衡常数分别为K1、K2,则K1>K2 | |
| B. | a、b两点的反应速率:b>a | |
| C. | 为了提高Br2(g)的转化率可采取增加Br2(g)通入量的方法 | |
| D. | b、c两点的HBr的体积分数b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com