
将0.l mol·L-1醋酸溶液加水稀释,下列说法正确的是
A.溶液中c(H+)和c(OH-)都减小 B.溶液中c(H+)增大
C.醋酸电离平衡向左移动 D.溶液的pH增大
D
【解析】
试题分析:将0.l mol·L-1醋酸溶液加水稀释,促进电离 溶液中c(H+)减小 醋酸电离平衡向右移动,由于Kw是常数所以c(OH-) 增大 ,所以溶液的pH增大。故选D。
考点:加水对弱酸电离的影响
点评:加水后虽然促进电离,但是除了c(OH-)所有物质浓度都会降低,
醋酸是弱酸,部分电离,加水可以促进平衡向右移动,即促使未电离的醋酸分子继续电离。
虽然CH3COOH的电离程度在增大,但体积的增大占主要因素,c(H+)又是逐渐减小的。
CH3COOH溶于水后,能电离出CH3COO-和H+,同时CH3COO-和H+又结合成CH3COOH分子,这就是动态平衡。加水后,离子间距离变大,结合成分子的可能性变小。所以…
从另一个方面解释,电离平衡常数是溶液中的电离出来的各离子浓度乘积(c(A+)*c(B-))与溶液中未电离的电解质分子浓度(c(AB))的比值。它只与温度有关,一定温度下是常数!!!溶液稀释后,比值变小(如稀释到一半浓度时,两种离子和醋酸分子的浓度都为1/2,它们的比值成了电离平衡常数的一半了)。而电离平衡常数只与温度有关,在温度不变下,为了达到电离平衡,醋酸分子继续电离,以使得它们比值增大到与电离平衡常数相等。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
(1)常温下,将0.1 mol·L-1的醋酸溶液和0.1 mol·L-1醋酸钠溶液等体积混合,测得溶液显酸性,则该混合液中c(CH3COOH)_____________c(CH3COO-);c(Na+)+c(H+)___________c(CH3COO-)+c(OH-)
(2)常温下,将0.1 mol·L-1的HCN溶液和0.1 mol·L-1的NaCN溶液等体积混合,测得混合液中c(HCN)>c(CN-),(假设混合过程中溶液体积的改变忽略不计)。则该混合液的pH________7,c(HCN)+c(CN-)0.1 mol·L-1,![]() __________c(OH-)。
__________c(OH-)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省八校高三第二次联考理综化学试卷(解析版) 题型:选择题
下列说法正确的是
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n 倍,则pH=a+n;
②已知BaSO4的Ksp=c(Ba2+)·c(SO42-),所以在BaSO4溶液中有c(Ba2+)= c(SO42-)=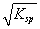
③将0.1mol·L-1的NaHS和0.1mol·L-1 Na2S溶液等体积混合,所得溶液中有c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S)
④在0.1 mol·L-1氨水中滴加0.1mol·L-1盐酸,刚好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol·L-1
A.①④???????? B.②③???????? C.③④????? D.①②
查看答案和解析>>
科目:高中化学 来源:2013届陕西省渭南市高二上学期期中考试化学试卷 题型:选择题
将0.l mol·L-1 醋酸溶液加水稀释,下列说法正确的是 ( )
A 溶液中c(H+)和c(OH-)都减小 B 溶液中c(H+)增大
C 醋酸电离平衡向左移动 D 溶液的pH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com