
| A. | Na2C2O4溶液中,2c(Na+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4) | |
| B. | 0.1 mol•L-1的醋酸钠溶液20 mL与0.1 mol•L-1盐酸10 mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | 等体积等物质的量浓度的NaCl和NaClO溶液,两份溶液中离子总数相比前者大 | |
| D. | 0.1mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
分析 A、根据物料守恒得:$\frac{1}{2}$c(Na+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4);
B、0.1 mol•L-1的醋酸钠溶液20 mL与0.1 mol•L-1盐酸10 mL混合后得到等物质的量浓度的醋酸钠、氯化钠和醋酸,而溶液显酸性以醋酸的微弱的电离为主;
C、HClO是弱酸,所以NaClO溶液中发生水解反应:ClO-+H2O?HClO+OH-,使溶液呈碱性,氢离子浓度小于10-7mol/L,所以NaCl溶液中C(Na+)+C(H+)大于NaClO溶液中C(Na+)+C(H+),根据电荷守恒:C(Na+)+C(H+)=C(OH-)+c(Cl-)可得溶液中离子总数为2×[c(Na+)+c(H+)]×V;同理可得NaClO溶液中总数为2×[c(Na+)+c(H+)]×V,所以NaCl溶液中离子总数大于NaClO溶液;
D、0.1mol?L-1的NaHA溶液,其pH=4,说明电离程度大于水解程度.
解答 解:A、根据物料守恒得:$\frac{1}{2}$c(Na+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4),所以c(Na+)=2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4),故A错误;
B、0.1 mol•L-1的醋酸钠溶液20 mL与0.1 mol•L-1盐酸10 mL混合后得到等物质的量浓度的醋酸钠、氯化钠和醋酸,而溶液显酸性以醋酸的微弱的电离为主,所以离子浓度大小为:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故B错误;
C、HClO是弱酸,所以NaClO溶液中发生水解反应:ClO-+H2O?HClO+OH-,使溶液呈碱性,氢离子浓度小于10-7mol/L,所以NaCl溶液中C(Na+)+C(H+)大于NaClO溶液中C(Na+)+C(H+),根据电荷守恒:C(Na+)+C(H+)=C(OH-)+c(Cl-)可得溶液中离子总数为2×[c(Na+)+c(H+)]×V;同理可得NaClO溶液中总数为2×[c(Na+)+c(H+)]×V,所以NaCl溶液中离子总数大于NaClO溶液,故C正确;
D、0.1mol?L-1的NaHA溶液,其pH=4,说明电离程度大于水解程度,所以c(HA-)>c(H+)>c(A2-)>c(H2A),故D错误;
故选C.
点评 本题考查离子浓度大小的比较,涉及了盐类水解和电荷守恒,难度不大,根据所学知识即可完成.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验方案 | 实验目的或结论 |
| A | 将盐酸酸化的双氧水滴入Fe(NO3)2溶液中,溶液变黄色 | H2O2的氧化性比Fe3+强 |
| B | 将一小块钠分别投入盛有水和乙醇的小烧杯中,钠与乙醇反应要平缓得多 | 乙醇羟基中的氢原子不如水分子中的氢原子活泼 |
| C | 将某气体通入品红溶液,溶液褪色 | 气体中一定有SO2 |
| D | 将铁棒和铜棒用导线连接后放入浓硝酸中,铜棒变细 | 铜的金属性强于铁 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4溶液与Ba(OH)2溶液混合 | B. | NH4Cl溶液与Ca(OH)2溶液混合 | ||
| C. | HNO3溶液与KOH溶液混合 | D. | Na2HPO4溶液与NaOH溶液混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 第四周期元素中,锰原子价电子层中未成对电子数最多 | |
| B. | 第二周期主族元素的原子半径随核电荷数增大依次减小 | |
| C. | 卤素氢化物中,HCl的沸点最低的原因是其分子间的范德华力最小 | |
| D. | 价层电子对相斥理论中,π键电子对数不计入中心原子的价层电子对数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
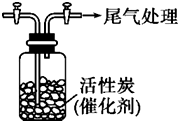 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2在常温下为无色液体,极易水解,遇潮湿空气会产生白雾.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2在常温下为无色液体,极易水解,遇潮湿空气会产生白雾.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
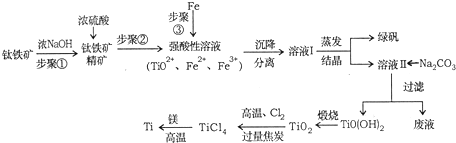
| PH | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | TiO(OH)2 |
| 开始沉淀 | 1.1 | 4.5 | 7 | 1 |
| 完全沉淀 | 2.8 | 6.4 | 9.2 | 2.7 |
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C57H104O6 | B. | C57H108O6 | C. | C57H106O6 | D. | C57H102O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Z、W均可形成两种常见氧化物 | |
| B. | 四种元素在自然界均不能以游离态存在 | |
| C. | 元素X、Y、W的最高化合价均与其族序数相等 | |
| D. | 离子半径:W>Z>Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com