
下列有关叙述中正确的是
A.Mg和Al都可以用电解法冶炼得到
B.Na2O2、Na2O组成元素相同,与CO2反应产物也相同
C.用过量的KSCN溶液除去FeCl2溶液中的少量FeCl3
D.Mg和Fe在一定条件下与水反应都生成H2和对应的碱
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源:2014高考名师推荐化学氧化还原概念(解析版) 题型:选择题
被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价)
A.NaBH4既是氧化剂又是还原剂
B.NaBH4是氧化剂,H2O是还原剂
C.硼元素被氧化,氢元素被还原
D.被氧化的元素与被还原的元素质量之比为1∶1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学气体制备(解析版) 题型:选择题
下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是
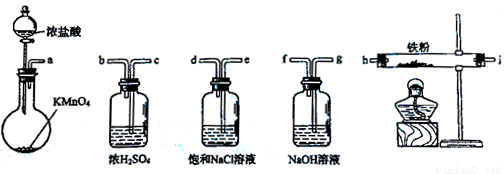
A.a-b-c-d-e-e-f-g-h
B.a-e-d-c-b-h-i-g
C.a-d-e-c-b-h-i-g
D.a-c-b-d-e-h-i-f
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学无机物性质及应用(非金属)(解析版) 题型:选择题
下列说法正确的是
A.二氧化硫可广泛用于食品的增白
B.能使湿润的淀粉KI试纸变成蓝色的物质一定是Cl2
C.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
D.可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学无机物性质及应用(非金属)(解析版) 题型:选择题
下列有关物质应用的说法中,正确的是
A.用石英器皿盛装氢氟酸
B.臭氧具有强还原性,可用于自来水的杀菌消毒
C.Fe3+具有氧化性,可腐蚀印刷线路板上的铜
D.硫酸钡俗称“钡餐”,可用于治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学无机物性质及应用(金属)(解析版) 题型:选择题
下列说法正确的是
A.铝箔在空气中受热熔化,并不滴落,说明铝与氧气没有发生化学反应
B.硅在电子工业中是最重要的半导体材料,广泛用于制作光导纤维
C.二氧化硫是一种有毒气体,所以不能用于杀菌消毒
D.氨很容易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学探究组成、性质的实验方案的设计与评价(解析版) 题型:实验题
某研究性学习小组在网上收集到如下信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
实验:将燃烧的钠迅速伸入到盛满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上黏附着白色物质。
提出假设
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
设计实验方案验证假设
该小组对燃烧后的白色产物
进行如下探究:
实验方案 | 实验操作 | 实验现象 | 结论 |
方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 |
|
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
【思考与交流】
(1)甲同学认为方案1得到的结论不正确,其理由是 。
(2)乙同学认为方案2得到的结论正确,白色物质为 。
(3)通过方案1和方案2的实验,你认为上述三个假设中, 成立。你的理由是 。
(4)钠在二氧化碳中燃烧的化学方程式为 。
(5)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点?并简述理由: 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学弱电解电离(解析版) 题型:填空题

提示:在本实脸条件下,Ni(Ⅱ)不能被氧化:高锰酸钾的还原产物是MnO2
回答下列问题:
(1)反应②中除掉的杂质离子是 ,发生反应的离子方程式为 ;在加高锰酸钾溶液前,若pH较低,对除杂的影响是 。
(2)反应③的反应类型为 ,过滤得到的滤渣中,除了过量的锌外还有 。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是 。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2取干操后的滤饼11.2g,煅烧后可得到产品8.1g,则x等于 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学工业流程图分析(解析版) 题型:填空题
氯碱工业中电解饱和食盐水的原理示意图如下图所示:

(1)溶液A的溶质是 ;
(2)电解饱和食盐水的离子方程式是 ;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 ;
(4)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42->c(Ca2+)]。精致流程如下(淡盐水和溶液A来自电解池):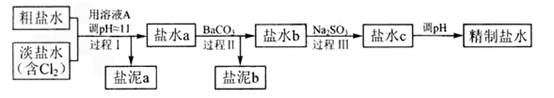
①盐泥a除泥沙外,还含有的物质是 。
②过程Ⅰ中将NH4+转化为N2的离子方程式是 。 ③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com