
| A. | X、Y、Z三种元素可形成化合物X3YZ4 | |
| B. | X、Y两元素形成的化合物只可能为离子化合物 | |
| C. | Y、Z两元素形成的化合物均会对空气造成污染 | |
| D. | 稳定性:Y的氢化物大于Z的氢化物 |
分析 X、Y、Z为短周期元素,X原子最外层只有一个电子,则X属于第IA族元素,最外层电子数不大于8,Y原子的最外层电子数比内层电子总数少4,则Y位于第三周期,则Y最外层电子数是6,为S元素;Z的最外层电子数是内层电子总数的三倍,最外层电子数不大于8,则其内层为K层,则Z原子最外层电子数是6,则为O元素,再结合题目分析解答.
解答 解:X、Y、Z为短周期元素,X原子最外层只有一个电子,则X属于第IA族元素,最外层电子数不大于8,Y原子的最外层电子数比内层电子总数少4,则Y位于第三周期,则Y最外层电子数是6,为S元素;Z的最外层电子数是内层电子总数的三倍,最外层电子数不大于8,则其内层为K层,则Z原子最外层电子数是6,则为O元素,
A.X是第IA族元素、Y是S元素、Z是O元素,X、Y、Z三种元素可形成化合物X2YZ3或X2YZ4,故A错误;
B.X、Y两元素形成的化合物是共价化合物H2S,故B错误;
C.Y是S元素、Z是O元素,二者形成的化合物二氧化硫和三氧化硫均会对空气造成污染,故C正确;
D.非金属性Y<Z,则稳定性:Y的氢化物<Z的氢化物,故D错误;
故选C.
点评 本题考查了原子结构和元素周期律,从化合物中存在的化学键、氢化物的稳定性、化合物分子式等方面考查,正确推断元素是解本题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 采用加热方法消毒的目的是使蛋白质变性而杀灭细菌 | |
| B. | 石油分馏可得到石油气、汽油、煤油、柴油等 | |
| C. | “海水淡化”可以解决“淡水供应危机”,加入明矾可以使海水淡化 | |
| D. | 已知Ksp(MnS)>Ksp(CdS) 所以工业上用MnO2制取MnCl2时,用MnS除去溶液中含有的Cd2+离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
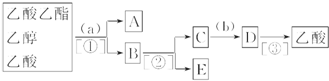
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
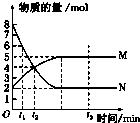 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从上到下,第IA族元素单质的密度逐渐增大 | |
| B. | 从上到下,第IA族元素单质的熔点逐渐降低 | |
| C. | 从上到下,第ⅦA族元素其氢化物的稳定性逐渐增强 | |
| D. | 从上到下,第ⅦA族元素其氢化物的沸点逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们单质的熔、沸点随核电荷数的增加逐渐降低 | |
| B. | 元素的非金属性随核电荷数的增加逐渐减小 | |
| C. | 它们原子的氧化性随核电荷数的增加逐渐增强 | |
| D. | 它们氢化物的稳定性随核电荷数的增加逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物浓度减小,反应速率减小 | |
| B. | 反应物浓度增加,反应速率增加 | |
| C. | 温度升高,反应速率增加 | |
| D. | 热水对反应起催化作用,从而加快了反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com