
【题目】工业上采用酸性高浓度含砷废水(砷主要以亚砷酸HAsO2形式存在,还含有少量Fe3+等杂质)提取重要化工原料As2O3。工艺流程如下:
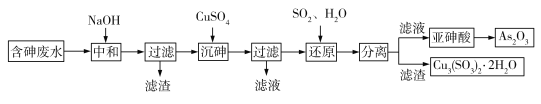
(1)“中和”时调节废水的pH为6,NaOH的作用是_____。
(2)“沉砷”时生成的沉淀是Cu(AsO2)2,发生反应的离子方程式是_____;此时使用了过量的CuSO4,原因是_____;沉砷时需控制体系的pH略显碱性,测得Cu(AsO2)2产物中铜元素含量较高,原因是_____。
(3)“还原”时发生反应的化学方程式是_____。
(4)下图表示其他条件不变下“还原”时,反应温度对砷浸出率和铜浸出率的影响(浸出率表示溶液中所要提取的元素被浸出的程度,即元素被浸出的百分率):
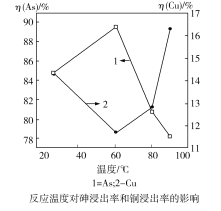
为达到铜砷分离尽量彻底的目的,应选择的最佳温度是_____。
【答案】中和H+,沉淀Fe3+(将Fe3+转化为沉淀),将HAsO2转化为![]() Cu2++2
Cu2++2![]()
![]() Cu(AsO2)2↓ 为了充分回收砷 产物含有少量氢氧化铜沉淀 3Cu(AsO2)2+3SO2+6H2O
Cu(AsO2)2↓ 为了充分回收砷 产物含有少量氢氧化铜沉淀 3Cu(AsO2)2+3SO2+6H2O![]() Cu3(SO3)2·2H2O+ 6HAsO2+H2SO4 60 ℃
Cu3(SO3)2·2H2O+ 6HAsO2+H2SO4 60 ℃
【解析】
工业上采用酸性高浓度含砷废水(砷主要以亚砷酸HAsO2形式存在,还含有少量Fe3+等杂质)提取重要化工原料As2O3。根据工艺流程图可知:加入NaOH,一方面中和酸性高浓度含砷废水中的氢离子,另一方面使杂质离子Fe3+形成沉淀除去,还可以将HAsO2转化为AsO2-,便于沉砷,加入CuSO4后转化为Cu(AsO2)2,过滤后加入SO2后转化为HAsO2加热可得As2O3。结合流程分析完成相应的问题。
(1)加入NaOH,一方面中和酸性高浓度含砷废水中的氢离子,另一方面使杂质离子Fe3+形成沉淀除去,还可以将HAsO2转化为![]() ,便于沉砷。答案:中和H+,沉淀Fe3+(将Fe3+转化为沉淀),将HAsO2转化为AsO2-。
,便于沉砷。答案:中和H+,沉淀Fe3+(将Fe3+转化为沉淀),将HAsO2转化为AsO2-。
(2)沉砷中![]() 与Cu2+形成沉淀:Cu2++2
与Cu2+形成沉淀:Cu2++2![]()
![]() Cu(AsO2)2↓;使用了过量的CuSO4,是为了充分回收砷;体系的pH略显碱性,容易形成氢氧化铜沉淀,氢氧化铜与Cu(AsO2)2相比,氢氧化铜中含铜量较高。答案:Cu2++2
Cu(AsO2)2↓;使用了过量的CuSO4,是为了充分回收砷;体系的pH略显碱性,容易形成氢氧化铜沉淀,氢氧化铜与Cu(AsO2)2相比,氢氧化铜中含铜量较高。答案:Cu2++2![]()
![]() Cu(AsO2)2↓ ;为了充分回收砷;产物含有少量氢氧化铜沉淀。
Cu(AsO2)2↓ ;为了充分回收砷;产物含有少量氢氧化铜沉淀。
(3)反应物是Cu(AsO2)2、SO2、H2O,生成物是 Cu3(SO3)2·2H2O和 HAsO2,Cu元素化合价降低,可知部分S元素化合价升高,根据原子守恒还有H2SO4生成,配平得:3Cu(AsO2)2+3SO2+6H2O![]() Cu3(SO3)2·2H2O+ 6HAsO2+H2SO4。答案:3Cu(AsO2)2+3SO2+6H2O
Cu3(SO3)2·2H2O+ 6HAsO2+H2SO4。答案:3Cu(AsO2)2+3SO2+6H2O![]() Cu3(SO3)2·2H2O+ 6HAsO2+H2SO4。
Cu3(SO3)2·2H2O+ 6HAsO2+H2SO4。
(4)根据图示,在60 ℃时,砷的浸出率最高,铜的浸出率最低,可以达到铜砷分离尽量彻底的目的。答案:60 ℃。


科目:高中化学 来源: 题型:
【题目】按以下步骤可由![]() 合成
合成![]() (部分试剂和反应条件已略去)。
(部分试剂和反应条件已略去)。
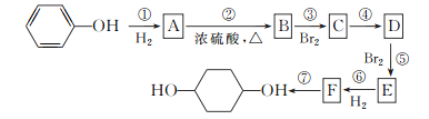
请回答下列问题:
(1)分别写出B、D的结构简式:B__,D___。
(2)反应①~⑦中属于消去反应的是__,属于加成反应的是__(填写序号)。
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到E的可能的结构简式为__。
(4)试写出C→D反应的化学方程式:__(有机物写结构简式并注明反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。

①仪器a的名称为_________,仪器b中装入的试剂可以是___________。
②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。

已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列溶液中微粒的物质的量浓度关系正确的是
A.CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L1]:c(Na+)=c(CH3COO)>c(CH3COOH)>c(H+)=c(OH)
B.20 mL 0.1 mol·L1 CH3COONa溶液中加入0.1 mol·L1盐酸至溶液pH=7:c(CH3COOH)=c(Cl)
C.0.1 mol·L1 CH3COOH溶液与0.1 mol·L1 Na2CO3溶液等体积混合(无气体逸出):c(![]() )>c(CH3COOH)+c(H2CO3)
)>c(CH3COOH)+c(H2CO3)
D.0.4 mol·L1 CH3COOH溶液和0.2 mol·L1 NaOH溶液等体积混合(pH<7):c(CH3COOH)>c(CH3COO)>c(Na+)>c(H+)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol CO2与0.3 mol C在恒压密闭容器中发生反应:CO2(g) + C(s)2CO(g)。平衡时,体系中各气体的体积分数与温度的关系如图。已知:用气体分压表示的化学平衡常数KP = ![]() ;气体分压(P分) = 气体总压(P总) ×体积分数。下列说法正确的是
;气体分压(P分) = 气体总压(P总) ×体积分数。下列说法正确的是
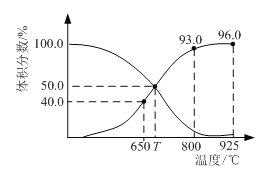
A.650℃时,CO2的平衡转化率为25%
B.800℃达平衡时,若充入气体He,v正 < v逆
C.T ℃达平衡时,若充入等体积的CO2和CO时,v正 > v逆
D.925℃时,用平衡气体分压表示的化学平衡常数KP = 23.04P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.相对分子质量为72的某烷烃,一氯代物有4种
B.四苯基乙烯![]() 中所有碳原子一定处于同一平面
中所有碳原子一定处于同一平面
C.在一定条件下,苯与液溴、浓硝酸生成溴苯、硝基苯的反应都属于取代反应
D.![]() 和
和![]() 分子组成相差一个“-CH2-”,因此是同系物
分子组成相差一个“-CH2-”,因此是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应H2SO4既表现氧化性,又表现出酸性的是
A.Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
B.Zn+ H2SO4==ZnSO4+H2↑
C.C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
D.CuO+ H2SO4=CuSO4 +2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中含有的少量杂质(括号中的物质)的方法中错误的是( )
A.H2(HCl):通过水洗涤再干燥
B.NO(NO2):通过水洗涤再干燥
C.Na2CO3固体(NaHCO3):加热混合物
D.Fe2+溶液(Fe3+):加入Cu片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A.氨水中加酸,NH4+的浓度增大
B.合成氨工业中不断从反应混合物中液化分离出氨气
C.实验室中常用排饱和食盐水的方法收集Cl2
D.合成氨控制在500℃左右的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com