
【题目】常温下,用0.1000 mol · L-1NaOH溶液分别滴定20.00mL浓度均为0.1000 mol · L-1CH3COOH 溶液和HCN溶液,所得滴定曲线如图。下列说法不正确的是

A. 点①时:c(CN-)>c(Na+)>c(HCN)>c(OH-)
B. 点③时:c(Na+)=c(CH3COO-)>c(H+)
C. 点④时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
【答案】A
【解析】点①时,溶液呈碱性,c(OH-)> c(H+),根据电荷守恒,c(Na+) > c(CN-),A项错误;点③时,溶液呈中性,c(OH-)= c(H+)=10-7molL-1,根据电荷守恒,c(Na+)=c(CH3COO-)>c(H+),B项正确;点④时,醋酸与NaOH溶液恰好完全反应生成醋酸钠溶液,故c(Na+)>c(CH3COO-)>c(OH-)>c(H+),C项正确;点①和点②所示溶液中均存在物料守恒:c(CH3COO-)+ c(CH3COOH)= c(HCN)+c(CN-)=0.067 mol · L-1,即有:c(CH3COO-)-c(CN-)=
c(HCN)-c(CH3COOH),D项正确。


科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图。下列分析不正确的是( )
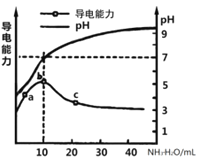
A. a~b点导电能力增强说明HR为弱酸
B. a、b点所示溶液中水的电离程度不相同
C. b恰好完全中和,pH=7说明NH4R没有水解
D. c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空
(1)按要求完成下列问题:
① 甲基的电子式_________;
② 写出制备TNT的化学方程式__________;
③写出2-溴丙烷消去反应的化学方程式__________;
④ 写出实验室制乙炔的化学方程式__________;
⑤![]() 含有的官能团的名称为__________;
含有的官能团的名称为__________;
(2)某有机物的结构简式为 据此填写下列空格。
据此填写下列空格。
① 该物质苯环上一氯代物有__________;
② lmol该物质和溴水混合,消耗Br2的物质的量为__________mol;
③ lmol该物质和H2加成需H2__________mol。
(3)![]() 与一定量的Br2发生加成反应,生成的产物可能是_______。
与一定量的Br2发生加成反应,生成的产物可能是_______。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
(4)环蕃A(cyclophane)和超蕃B(superphane)是一种光电信息材料,都属于烃(B中氢原子未画出),它们的结构如图所示。

下列有关说法正确的是__________
A.环蕃和超蕃互为同系物 B.环蕃能使酸性高锰酸钾溶液褪色
C.环蕃能与液溴、硝酸发生取代反应 D.超蕃的一氯取代物只有l种,二氯取代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一定容积的密闭容器中进行,则下列说法或结论中,能够成立的是( )
CO(g)+H2(g)在一定容积的密闭容器中进行,则下列说法或结论中,能够成立的是( )
A. 其他条件不变仅将容器的体积缩小一半,反应速率减小
B. 保持体积不变,当混合气体密度不变时,反应达到平衡状态
C. 保持体积不变,充入少量He使体系压强增大,反应速率一定增大
D. 其他条件不变,适当增加C(s)的质量会使反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要有于制作窗框、卷帘门、防护栏等.下列与这些用途无关的性质是( )
A.导电性好
B.不易生锈
C.光泽度好
D.强度高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式____________________。

(2)已知:
N2(g)+O2(g)=2 NO(g) △H=+180 kJ·mol-1
2NO(g)+2 CO(g)=N2(g)+2 CO2(g)△H=-746 kJ·mol-1
则反应CO(g)+1/2O2(g)=CO2(g)的△H=________kJ·mol-1。
(3)在一固定容积为2L的密闭容器内加人0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应。N2(g)+3H2(g)![]() 2NH3(g)△H<0,若第5min时达到平衡,此时测得NH3的物质的量为0.2mol,则前5min的平均反应速率v(N2)为_________,平衡时H2的转化率为_________,该反应的平衡常数K=__________(计算结果保留一位小数)。
2NH3(g)△H<0,若第5min时达到平衡,此时测得NH3的物质的量为0.2mol,则前5min的平均反应速率v(N2)为_________,平衡时H2的转化率为_________,该反应的平衡常数K=__________(计算结果保留一位小数)。
(4)在固定体积的密闭容器中,1.0×103kPa时,反应N2(g)+3H2(g)![]() 2NH3(g) △H <0的平衡常数K与温度T的关系如下表:则K1_________K2(填写“>”、“=”或“<”)
2NH3(g) △H <0的平衡常数K与温度T的关系如下表:则K1_________K2(填写“>”、“=”或“<”)
T/K | 298 | 398 | 498 |
平衡常数K | 51 | K1 | K2 |
(5)在体积一定的密闭容器中能说明合成氨反应一定达到平衡状态的是____(填字母)
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.NH3的浓度保持不变
c.容器内压强保持不变
d.混合气体的密度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com