
| A. | 煤炭 | B. | 氢气 | C. | 天然气 | D. | 石油 |
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:解答题
 .请根据图回答:
.请根据图回答:
 .
. ; ②CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O.
; ②CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,Y
,Y ,Z
,Z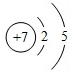 ,W
,W .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
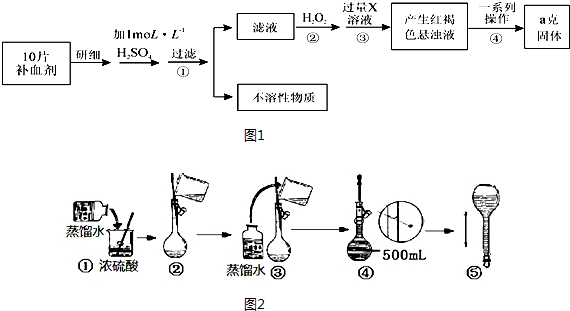
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
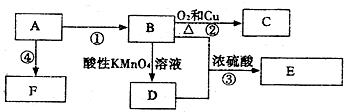
 ,C的名称乙醛,
,C的名称乙醛,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑥⑦ | B. | ③④⑤⑥⑦ | C. | ①②③⑤⑦⑥ | D. | ①③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com