
分析 (1)钠元素在化合物中只能形成+1价,据此结合生成氢气的物质的量判断其化学式即可;
(2)NaH与AlCl3反应可得到NaAlH4,此反应无化合价的变化,据此书写;
(3)NaAlH4与水反应生成氢气,应是水中的H元素与NaH中的H元素之间得失电子,据此书写即可;
(4)由题意可知NaH常做还原剂那么铁锈为氧化剂,反应生成铁单质,据此书写;
(5)制备过程中未指明吸收杂质气体HCl,据此解答;氢气与金属钠反应未指明钠的用量,钠可能过量,过量的钠也可以与水反应生成氢气.
解答 解:(1)Na在化合价中呈现+1价,故该物质的化学式可能为NaH,又甲与AlCl3反应可得到NaAlH4,Al的化合价为+3,故H元素的化合价为-1,4.80g甲加热至完全分解,得到金属钠和2.24L,即0.1mol氢气,
化学反应方程式为:2NaH$\frac{\underline{\;加热\;}}{\;}$2Na+H2↑
48g 22.4L
4.8g 2.24L
故此化合物为NaH,故答案为:NaH;
(2)NaH与AlCl3反应可得到NaAlH4,此反应无化合价的变化,根据原子守恒推测另一种生成物,化学反应方程式为:4NaH+AlCl3=NaAlH4+3NaCl,故答案为:4NaH+AlCl3=NaAlH4+3NaCl;
(3)NaAlH4与水反应生成氢气,即NaH中H化合价升高,水中H元素化合价降低,化学反应方程式为:NaAlH4+2H2O=NaAlO2+4H2↑,故答案为:NaAlH4+2H2O=NaAlO2+4H2↑;
(4)NaH常做还原剂(H化合价升高为+1价),铁锈在此为氧化剂(Fe化合价降低为0价),反应生成铁单质,化学反应方程式为:3NaH+Fe2O3=2Fe+3NaOH,故答案为:3NaH+Fe2O3=2Fe+3NaOH;
(5)稀盐酸具有挥发性,且可以利用浓硫酸干燥,故制取的氢气中可能混有杂质气体HCl,那么制取的甲中就混有NaCl,验证过程中未排除金属钠的干扰,过量的金属能也可以与水反应生成氢气.
故答案为:制备过程不合理,因为盐酸易挥发,氢气中混有HCl,导致产物中有NaCl;验纯方法不合理,如果有Na残留,Na与水反应也产生氢气,且没有考虑混入的NaCl.
点评 本题主要考查的是常见元素以及其化合物的知识,综合性较强,涉及物质的判断、化学反应方程式书写、实验方案的评价等,难度较大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
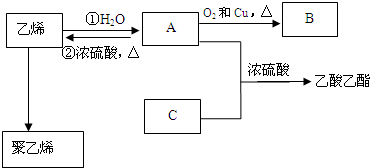
 ,化合物C所含官能团的名称为羧基.
,化合物C所含官能团的名称为羧基. $→_{△}^{浓硫酸}$R-CH=CH2+H2O,写出反应②的反应方程式(标明反应条件):CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$H2O+CH2=CH2↑.
$→_{△}^{浓硫酸}$R-CH=CH2+H2O,写出反应②的反应方程式(标明反应条件):CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$H2O+CH2=CH2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 26 | B. | 29.1g | C. | 29.5g | D. | 24g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等.回答下列问题:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②④ | C. | ①② | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 据2006年11月12 中央电视台每周质量报告报道,北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将其列为三类致癌物.
据2006年11月12 中央电视台每周质量报告报道,北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将其列为三类致癌物. 空间结构,且是不能旋转不然,双键就会被破坏,而单键是可以旋转的,则肯定共线的原子最多有12个.
空间结构,且是不能旋转不然,双键就会被破坏,而单键是可以旋转的,则肯定共线的原子最多有12个.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| C. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4 NH3•H2O═AlO2-+4NH4+ | |
| D. | 向CuSO4溶液中加入Na:2 Na+Cu2++2H2O═2Na++Cu(OH)2↓+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com