
【题目】设NA为阿伏伽德罗常数的数值。下列有关叙述正确的是
A. pH=1的硫酸溶液中含有的SO42-数目为0.05NA
B. 100g质量分数为46%的乙醇溶液中所含的氢原子数为12NA
C. 100mL 1mol/L CH3COONH4 溶液中含有的NH4+数目为0.1NA
D. 0.2molNH3与0.3molO2在催化剂的作用下加热充分反应,所得NO的分子数为0.2NA
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )

A. 原子半径:Z>W>X>Y
B. 元素X、Z的最高化合价分别与其主族序数相等
C. 最高价氧化物对应水化物的酸性:Y>X>W
D. 最简单气态氢化物的热稳定性:Y>X>W>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3 、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取的七水硫酸镁在印染、造纸和医药等工业上都有广泛的应用。硼镁泥制取七水硫酸镁的工艺流程如下:

回答下列问题:
(1)Na2B4O7·10H2O中B的化合价为________________。
(2)Na2B4O7易溶于水,也较易发生水解:B4O72-+7H2O![]() 4H3BO3(硼酸)+2OH-,(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:_________________________________。
4H3BO3(硼酸)+2OH-,(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:_________________________________。
(3)滤渣B中含有不溶于稀盐酸但能溶于浓盐酸的黑色固体,写出生成黑色固体的离子方程式_________________。
(4)加入MgO的目的是_____________________。
(5)己知MgSO4、CaSO4的溶解度如下表:
温度(℃) 溶解度(g) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
操作“A”是将MgSO4:和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明“操作A”步骤为____________________。
(6)Na2B4O7·10H2O失去全部结晶水后的硼砂与金属钠、氢气及石英砂一起反应可制备有机化学中的“万能还原剂——NaBH4”(该过程B的化合价不变)。
①写出NaBH4的电子式_____________。
②“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaBH4的有效氢含量为_____(计算结果保留两位小数)。
③在碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,写出阴极室的电极反应式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向体积均为15.0mL,浓度均为1.00mol/L的氨水和NaHCO3溶液中分别滴加1.00mol/L的盐酸,溶液的pH与所加盐酸体积的关系如图所示。下列有关叙述正确的是

A. 曲线a是NaHCO3溶液的滴定曲线
B. 当V(盐酸)=4.00mL时,c(HCO3-)>c(NH4+)>c(CO32-)
C. 当V(盐酸)=15.00mL时,c(Na+)=c(NH4+)
D. 两个滴定过程均可选择酚酞作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应3A(g)![]() 3B(?)+C(?) △H>0达到化学平衡后,
3B(?)+C(?) △H>0达到化学平衡后,
(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量 ;
②若B、C都不是气体,气体的平均相对分子质量 ;
③若B是气体,C不是气体,气体的平均相对分子质量 ;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是 态,C是 态。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将碘水倒入汽油中,下列现象描述正确的是( )
A. 汽油在上层,水在下层,汽油无色
B. 汽油在下层,水在上层,汽油紫色
C. 汽油在上层,水在下层,水无色
D. 水在上层,汽油在下层,汽油紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2002年诺贝尔化学奖获得者的贡献之一是发明了对有机分子的结构进行分析的质谱法。其方法是让极少量(10-9g左右)的化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+、……然后测定其质荷比β。设H+的质荷比为1,某有机物样品的质荷比如下图(假设离子均带一个单位正电荷,信号强度与该离子多少有关),则该有机物可能

A. CH3OH B. C3H8 C. C2H4 D. CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验,将A逐滴加入B中:
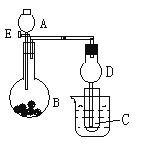
(1)若B为Na2CO3粉末,C为C6H5ONa溶液,实验中观察到小试管内溶液由澄清变浑浊,则试管C中化学反应的化学方程式: 。然后往烧杯中加入沸水,可观察到试管C中的现象: 。
(2)若B是生石灰,观察到C溶液中先形成沉淀,然后沉淀溶解。当沉淀完全溶解,恰好变澄清时,关闭E然后往小试管中加入少量乙醛溶液,再往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是 (填名称),C是 (填化学式),与乙醛的混合后,该溶液中反应的化学方程式: 。实验结束时用 清洗银镜。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com