
| A. | PH3分子呈三角锥形 | B. | PH3分子是极性分子 | ||
| C. | 键能:P-H>N-H | D. | PH3在空气中易自燃 |
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| A. | V(A)=0.6 mol/(L•s) | B. | V(B)=0.4 mol/(L•s) | C. | V(C)=0.7 mol/(L•s) | D. | V(D)=1 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁烷是直链烃,是因为分子中4个碳原子在同一条直线上 | |
| B. | 丙烷的一氯代物有2种,丙烷的二氯代物有4种 | |
| C. | 丙烯中所有原子均在同一平面上 | |
| D. | 甲苯上的某一个氢原子被-C3H7取代后,所得有机产物有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用下图装置可以测定混合气体中ClO2的含量
用下图装置可以测定混合气体中ClO2的含量查看答案和解析>>
科目:高中化学 来源: 题型:解答题
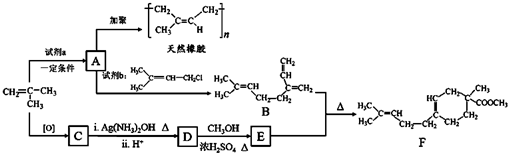
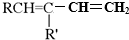
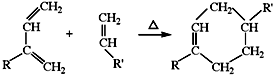 (R、R′可以是氢原子、烃基或官能团)
(R、R′可以是氢原子、烃基或官能团) .
.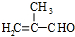 .
.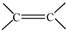 和
和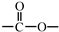 结构的D的所有同分异构共有7种(不包括顺反异构体),写出其中任意两种的结构简式CH2=CHCH2COOH、CH2=CHCOOCH3等.
结构的D的所有同分异构共有7种(不包括顺反异构体),写出其中任意两种的结构简式CH2=CHCH2COOH、CH2=CHCOOCH3等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cu2+、Cl-、SO42- | B. | Fe2+、K+、S2-、SO42- | ||
| C. | Na+、Ca2+、Cl-、HCO3- | D. | H+、Al3+、NH4+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 密度不变 | B. | 温度不变 | C. | 颜色不变 | D. | 压强不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子内电子数多于中子数 | B. | 与${\;}_{117}^{296}$Uus电子式相同 | ||
| C. | 元素的近似相对原子质量是294 | D. | 处于不完全周期内 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
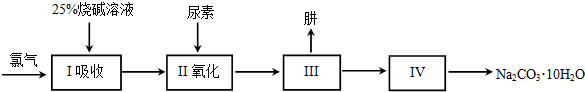
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com