
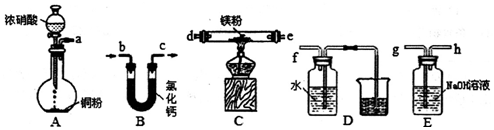
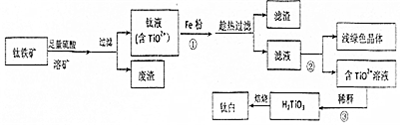
分析 (1)Mg在NOx中的燃烧生成MgO、N2,Mg与氮气燃烧生成Mg3N2;
(2)验证产物中有N2:A装置由铜粉和浓硝酸反应制备氮氧化物(Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+H2O),经过氯化钙干燥后的氮氧化物与Mg份充分反应,干燥生成的气体,由氢氧化钠溶液吸收未反应完的氮氧化物后,将气体通入水中,氮气不溶于水,将D装置中的水压入烧杯中,为防止空气中氮气的干扰,故应先用A装置生成的氮氧化物将装置内的空气排尽,再与Mg发生反应;
(3)Mg3N2与水反应生成氨气,检验是否生成氨气即可检验Mg与NOx反应产物中是否存在Mg3N2;
(4)甲同学的推测为铵根离子水解使溶液显酸性,氧化镁与酸性溶液反应,促进铵根离子水解生成氨气,乙同学的推测为铵根离子与氧化镁反应,取含有铵根离子的中性溶液即可检验甲乙同学推测的合理性.
解答 解:(1)Mg在NOx中的燃烧生成MgO、N2,反应为:2xMg+2NOx$\frac{\underline{\;点燃\;}}{\;}$2xMgO+N2,Mg与氮气燃烧生成Mg3N2,反应为:3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2;
故答案为:2xMg+2NOx$\frac{\underline{\;点燃\;}}{\;}$2xMgO+N2、3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2;
(2)①A装置由铜粉和浓硝酸反应制备氮氧化物,经过氯化钙干燥后的氮氧化物与Mg粉充分反应,干燥生成的气体,由氢氧化钠溶液吸收未反应完的氮氧化物后,将气体通入水中,氮气不溶于水,将D装置中的水压入烧杯中,故连接顺序为abcdebdghf;为防止空气中氮气的干扰,安装仪器后,首先检查装置的气密性,先用A装置生成的氮氧化物将装置内的空气排尽,即:打开分液漏斗,待红棕色气体充满整个装置后,再与Mg发生反应;
故答案为:abcdebdghf;打开分液漏斗,待红棕色气体充满整个装置后;
②A中的仪器为分液漏斗、平底烧瓶;A中的反应为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
故答案为:分液漏斗、平底烧瓶;Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
③氮气不溶于水,D中气体体积增大,可将D装置中的水压入烧杯中;
故答案为:装置D中气体体积增大,水从广口瓶流入烧杯中;
(3)Mg3N2与水反应生成氨气,检验是否生成氨气即可,方法为:取装置C中少量固体产物加入水中,若产生具有刺激性气体(或能使湿润分红色石蕊试纸变蓝)的气体,则证明产物中存在Mg3N2,否则不存在;
故答案为:取装置C中少量固体产物加入水中,若产生具有刺激性气体(或能使湿润分红色石蕊试纸变蓝)的气体,则证明产物中存在Mg3N2,否则不存在;
(4)甲同学的推测为铵根离子水解使溶液显酸性,氧化镁与酸性溶液反应,促进铵根离子水解生成氨气,乙同学的推测为铵根离子与氧化镁反应,取含有铵根离子的中性溶液如醋酸铵可检验,方法为:向MgO固体中加入过量的CH3COONH4溶液,若固体溶解且放出NH3,则证明乙同学推测合理,否则乙通常推测不合理;
故答案为:向MgO固体中加入过量的CH3COONH4溶液,若固体溶解且放出NH3,则证明乙同学推测合理,否则乙通常推测不合理.
点评 本题考查性质实验方案设计,侧重考查学生知识综合应用、根据实验目的及物质的性质进行排列顺、实验基本操作能力及实验方案设计能力,综合性较强,注意把握物质性质以及对题目信息的获取于使用,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol Cl2参加反应转移电子数一定为2NA | |
| B. | 1mol NaHCO3晶体中阳离子数为2NA | |
| C. | 常温常压条件下,14g乙烯和丁烯混合物含有的共用电子对数为3NA | |
| D. | 1ml•L-1 NaCl溶液中含有的Na+数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCCl4含有的分子数约为6.02×1023个 | |
| B. | 1L氢气一定比1L氧气质量少 | |
| C. | 含有6.02×1023个Fe3+的Fe2(SO4)3中SO42-的物质的量为3mol | |
| D. | 1molAl3+带有的正电荷数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  | 将稀盐酸与碳酸钠 溶液混合 | 5%的H2O2溶 液中滴入2滴 1molL-1氯化 铁溶液 |
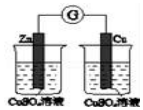
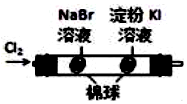
| 验证化学能 转化为电能 | 验证氧化性Cl2>Br2>I2 | 验证氯比氮的非金属性强 | 验证催化剂加快 反应速率 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| H2SO4溶液 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
| 1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.1mol/L | 2:03 |
| 1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
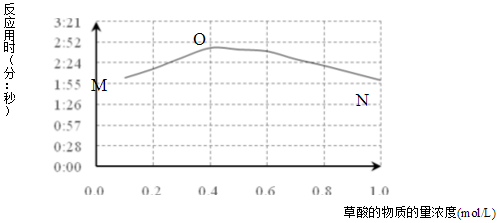
| a | KMnO4与H2C2O4反应是分步进行的,反应过程中生成Mn(VI)、Mn(III)、Mn(IV),最终变为无色的Mn(II).(括号中罗马数字表示锰的化合价) |
| b | 草酸根易与不同价态锰离子形成较稳定的配位化合物. |
| c | 草酸稳定性较差,加热至185℃可分解. |
| H2SO4溶液 | Na2SO4固体 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
| 1mL 0.1mol/L | 1.9×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 16:20 |
| 1mL 0.5mol/L | 1.5×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 8:25 |
| 1mL 1.0mol/L | 1.0×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 6:15 |
| 1mL 2.0mol/L | 0 | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.10 | 0.10 | 0.09 |
| ② | 800 | 0.20 | 0.20 | 0.10 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
| A. | 实验①中,若5min时测得n(M)=0.05mol,则0至5min时间内,用N表示的平均反应速率v(N)=0.01 mol/( L•min) | |
| B. | 实验②中,该反应的平衡常数K=1.0 | |
| C. | 实验③中,达到平衡时,X的转化率为60% | |
| D. | 实验④中,达到平衡时,b>0.06 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
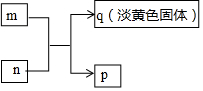 X、Y、Z、W是原子序数依次增大的短周期主族元素,其中Y、W同主族,W的最外层电子数为Z的2倍,m、n分别是X、Y与W形成的化合物,m、n有如图所示的转化关系,p为常见的液态化合物,q是W的单质.下列说法不正确的是( )
X、Y、Z、W是原子序数依次增大的短周期主族元素,其中Y、W同主族,W的最外层电子数为Z的2倍,m、n分别是X、Y与W形成的化合物,m、n有如图所示的转化关系,p为常见的液态化合物,q是W的单质.下列说法不正确的是( )| A. | 原子半径:Z>W>Y>X | |
| B. | 简单氢化物的稳定性:Y>W | |
| C. | m、n、p均为只含极性键的共价化合物 | |
| D. | Z、W形成的化合物可由两种盐溶液通过复分解反应制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
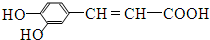 .下列有关说法中正确的是( )
.下列有关说法中正确的是( )| A. | 分子中含有四种官能团 | |
| B. | 可以用酸性高锰酸钾溶液检验碳碳双键 | |
| C. | 1mol咖啡酸与足量钠、碳酸氢钠溶液反应,在相同条件下生成气体的体积比为1:2 | |
| D. | 1mol咖啡酸可与4mol Br2发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com