
| A. | 由 1 mol CuFeS2 生成 1mol Cu,共消耗 2.75 molO2 | |
| B. | 该冶炼方法中产生大量的有害气体SO2,可回收用于制备硫酸 | |
| C. | 在反应③中,Cu2S既是氧化剂,又是还原剂 | |
| D. | 在反应①中,SO2既是氧化产物,又是还原产物 |
分析 ①2CuFeS2+4O2═Cu2S+3SO2+2FeO(炉渣)中,Cu元素的化合价由+2价降低为+1价,O元素的化合价由0降低为-2价,而S元素的化合价由-2价升高为0;
②2Cu2S+3O2═2Cu2O+2SO2中,O元素的化合价由0价降低为-2价,S元素的化合价由-2价升高为+4价;
③2Cu2O+Cu2S═Cu+SO2↑中,Cu元素的化合价由+1价降低为0,S元素的化合价由-2价升高为+4价,以此来解答.
解答 解:A.反应的总分应方程式为6CuFeS2+15O2=6Cu+12SO2+6FeO,由1molCuFeS2制取1molCu时,共消耗2.5molO2,故A错误;
B.铜的冶炼过程中,②焙烧、③制粗铜过程中都有二氧化硫生成,二氧化硫为制取硫酸的原料,可回收用于制备硫酸,故B正确;
C.在反应③中,Cu元素的化合价降低、S元素的化合价升高,则Cu2S既是氧化剂,又是还原剂,故C正确;
D.在反应①中,O元素的化合价降低,S元素的化合价升高,则SO2既是氧化产物,又是还原产物,故D正确;
故选A.
点评 本题考查金属的冶炼及氧化还原反应,为高频考点,把握反应中各元素的化合价的变化为解答的关键,选项A为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+2HCl═CuCl2+H2↑ | B. | Al2O3+3H2O═2Al(OH)3 | ||
| C. | Mg(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ MgO+H2O | D. | Ba(OH)2+SO2═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 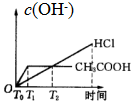 | B. | 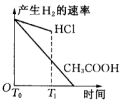 | C. |  | D. | 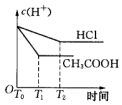 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
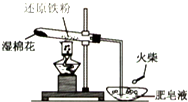 为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验.
为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
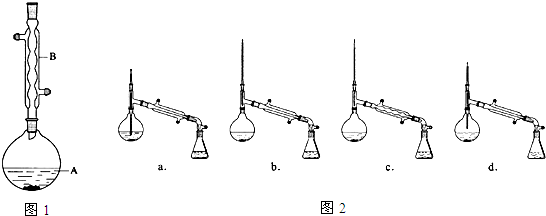
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
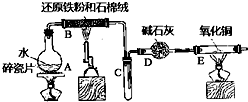 某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)请回答下列问题:
某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
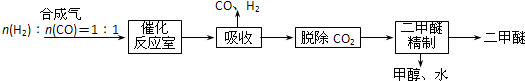
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com