
| A. | 大于零即可 | B. | 大于0.6mol | C. | 大于或等于1mol | D. | 任意值 |
分析 在恒温恒容条件下,C的浓度仍为1.2mol/L,假设反应完全逆向,则在折算之后要满足n(A)=2mol,n(B)=1mol,D为固体,对平衡移动没有影响,据此分析.
解答 解:在恒温恒容条件下,C的浓度仍为1.2mol/L,假设反应完全逆向,则在折算之后要满足n(A)=2mol,n(B)=1mol,所以加入的C和D分别为3mol和1mol,但又D为固体,对平衡移动没有影响,所以D只要能够与C反应达到平衡状态的量即可,所以D最少为$\frac{3-1.2}{3}$=0.6mol,所以B正确;
故选B.
点评 考查化学平衡的有关计算、等效平衡,难度中等,构建平衡建立的途径是解题关键,注意等效平衡规律:
1、恒温恒压下,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡;
2、恒温恒容下,若反应前后气体气体发生变化,按化学计量数转化到一边,满足对应物质的物质的量相等,为等效平衡;若反应前后气体的体积不变,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡


科目:高中化学 来源: 题型:解答题

 ,化合物中含有离子键键(填离子或共价)
,化合物中含有离子键键(填离子或共价)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
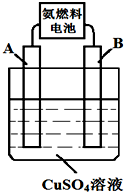 能源的开发、利用与人类社会的可持续发展息息相关,怎样充分利用好能源是摆在人类面前的重大课题.
能源的开发、利用与人类社会的可持续发展息息相关,怎样充分利用好能源是摆在人类面前的重大课题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
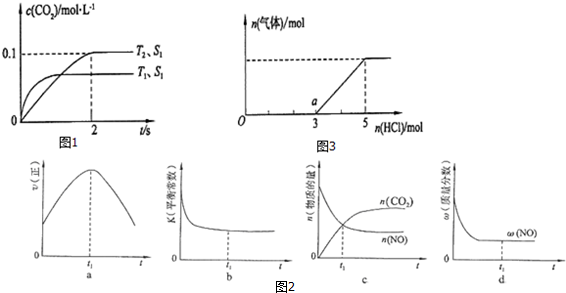
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA | |
| B. | 将含有0.1molFeCl3的饱和溶液滴入沸水中,产生胶粒的数目为0.1NA | |
| C. | 1molC7H16中含有共价键的数目为23NA | |
| D. | 常温下,1L 0.1 mol•L-1的Na2CO3溶液中含有的离子总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
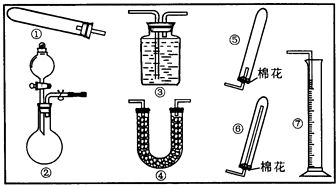
| 试剂组合/NH3体积(mL) | 6.0gCa(OH)2(s,过量) | 6.0NaOH(s,过量) | 6.0g CaO(s,过量) |
| 5.4g NH4Cl(s) | ①/1344 | ②/1568 | ③/1792 |
| 5.4(NH4)2SO4(s) | ④1364 | ⑤1559 | ⑥/1753 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com