
【题目】相同质量的下列各烃,完全燃烧后生成CO2最多的是( )
A. 甲烷B. 乙烷C. 乙烯D. 乙炔
科目:高中化学 来源: 题型:
【题目】下列各组物质不管它们以任何质量比混合,只要混合物的质量一定,则在完全燃烧时,消耗氧气的量恒定不变的是( )
A. HCHO和CH3COOHB. 乙烯与乙醇
C. 丙烯与苯乙烯( C6H5-CH=CH2 )D. 乙烷与乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 碱性锌锰电池是二次电池
B. 铅蓄电池是二次电池
C. 二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生
D. 燃料电池的活性物质没有储存在电池内部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 二氧化氯可用于自来水的消毒B. 氧化镁可用于制造耐高温材料
C. 把固体炸药制成胶体能提高威力D. 二氧化硫可以使石蕊试剂褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 硝酸银溶液保存在棕色的广口瓶中,防止见光分解
B. 用pH试纸测定浓度为18mol/L H2SO4溶液的pH
C. 分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
D. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中能大量共存的是( )
A.酸性溶液中:Na+、Cl﹣、OH﹣、CO32﹣
B.碱性溶液中:Fe3+、NH4+、HCO3﹣、Cl﹣
C.无色溶液中:Na+、Cu2+、MnO4﹣、I﹣
D.透明溶液中:Na+、Fe3+、Cl﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 100g 46%的乙醇溶液中,含H-O键的数目为NA
B. 1molNaHSO4在熔融状态下电离出的阳离子数为2NA
C. 氢氧燃料电池负极消耗1.12L气体时,电路中转移的电子数为0.1NA
D. 常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一.运用铁及其化合物的知识,完成下列问题.
Ⅰ.(1)所含铁元素既有氧化性又有还原性的物质是_______(用字母代号填).
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)取一定量氯化亚铁固体,配制成0.1 mol/L 的溶液。检验亚铁离子是否被氧化的方法:______________________________________________。
Ⅱ.工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等)制备绿矾FeSO4·7H2O的流程如下:
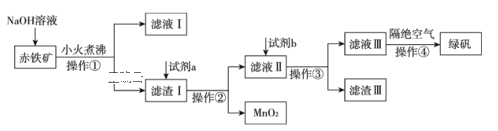
(1)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为____________;_________________。
(2)向滤渣Ⅰ中加入过量的试剂a为___________,过量的试剂b投入到滤液Ⅱ发生的所有反应的离子方程式为______________;_________________;________________。
(3)实验室中操作①②③的名称为_________________________。
(4)操作④隔绝空气的目的是_______________________________________________。
Ⅲ. 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中Na2O2 是________(填氧化剂、还原剂),与CO2反应的化学反应方程式_________________________。
(2)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:___________________________________________________________。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为____mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com