
分析 (1)取2.22g固体投人250mL0.2mol•L-1盐酸中,得到标准状况下气体224mL,得到的气体是二氧化碳,n(CO2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,c(Cu2+)=0.05mL•L-1,该溶液中n(Cu2+)=0.05mol/L×0.4L=0.02mol,同一化学式中,各微粒之比等于其物质的量之比,所以C、Cu原子个数之比=0.01mol:0.02mol=1:2,则x=2;
根据C原子守恒得n[Cux(OH)yCO3]=n(CO2)=0.01mol,则M[Cux(OH)yCO3]=$\frac{2.22g}{0.01mol}$=22g/mol,y=$\frac{222-64×2-60}{17}$=2,所以y=2;
(2)根据(1)知,2.22g Cu2(OH)2CO3的物质的量是0.01mol,4.44g Cu2(OH)2CO3的物质的量是0.02mol,碱式碳酸铜受热分解生成二氧化碳、水和黑色物质,该反应中没有元素化合价变化,所以生成的黑色物质是CuO,根据Cu原子守恒得n(CuO)=n[Cu2(OH)2CO3]=0.02mol,根据CuO+2HCl=CuCl2+H2O计算消耗盐酸体积;
(3)根据Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O计算消耗盐酸的物质的量,从而确定剩余盐酸物质的量,根据c=$\frac{n}{V}$计算稀释后氢离子浓度.
解答 解:(1)取2.22g固体投人250mL0.2mol•L-1盐酸中,得到标准状况下气体224mL,得到的气体是二氧化碳,n(CO2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,c(Cu2+)=0.05mL•L-1,该溶液中n(Cu2+)=0.05mol/L×0.4L=0.02mol,同一化学式中,各微粒之比等于其物质的量之比,所以C、Cu原子个数之比=0.01mol:0.02mol=1:2,则x=2;
根据C原子守恒得n[Cux(OH)yCO3]=n(CO2)=0.01mol,则M[Cux(OH)yCO3]=$\frac{2.22g}{0.01mol}$=22g/mol,y=$\frac{222-64×2-60}{17}$=2,所以y=2,
故答案为:x=y=2;
(2)根据(1)知,2.22g Cu2(OH)2CO3的物质的量是0.01mol,4.44g Cu2(OH)2CO3的物质的量是0.02mol,碱式碳酸铜受热分解生成二氧化碳、水和黑色物质,该反应中没有元素化合价变化,所以生成的黑色物质是CuO,根据Cu原子守恒得n(CuO)=n[Cu2(OH)2CO3]=0.02mol,根据CuO+2HCl=CuCl2+H2O得消耗盐酸体积=$\frac{0.02mol×2}{0.2mol/L}$=0.2L=200mL,
答:消耗盐酸体积为200mL;
(3)根据Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O得溶解0.01molCu2(OH)2CO3消耗盐酸0.04mol,n(HCl)(剩余)=0.2mol/L×0.25L-0.04mol=0.01mol,c(H+)=$\frac{n}{V}$=$\frac{0.01mol}{0.4L}$=0.025mol/L,
答:稀释后溶液中氢离子浓度为0.025mol/L.
点评 本题考查化学方程式的有关计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间关系是解本题关键,利用原子守恒分析解答即可,难点是x、y值的确定.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:填空题

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.0 | -- | -- |
| 沉淀完全时的pH | 3.7 | 9.6 | 11.0 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y2+ | B. | X2+ | C. | Z2+ | D. | H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| B. | 25℃时,1L pH=13的Ba(OH)2溶液中含Ba2+的数目为0.1NA | |
| C. | 12g金刚石中含有的共价键数为2NA | |
| D. | 7.1g氯气与足量热烧碱溶液反应,转移电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+,Na+,Br-,Fe3+ | B. | H+,K+,MnO${\;}_{{4}^{\;}}$-,C2O42- | ||
| C. | K+,H+,NO3-,I- | D. | Na+,H+,SO32-,S2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯气的实验室制法
氯气的实验室制法查看答案和解析>>
科目:高中化学 来源: 题型:解答题
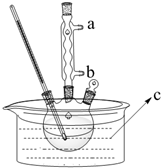 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置来合成正丁醚(其它装置均略去),发生的主要反应为:
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置来合成正丁醚(其它装置均略去),发生的主要反应为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com