
| A. | 含大量Al3+的溶液中:K+、Na+、NO3-、CO32-不能大量共存,因有Al2(CO3)3沉淀生成 | |
| B. | 含大量Fe3+的溶液中:K+Mg2+、I-、Br2-不能大量共存,因2Fe3++2I-=2Fe2++I2 | |
| C. | 由水电离的c(H+)=1×10-14mol/L的溶液中:Ca2+、NO3-、HCO3-、Cl-不能大量共存,因溶液呈酸性,与HCO3-反应产生CO2气体 | |
| D. | 在NH4Fe(SO4)2溶液中:Na+、K+、S2-、SCN-不能大量共存,只是因Fe3+和S2-反应产生淡黄色的S沉淀 |
分析 A.铝离子与碳酸根离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;
B.铁离子能够将碘离子氧化成碘单质;
C.由水电离的c(H+)=1×10-14mol/L的溶液中存在大量氢离子或氢氧根离子,碳酸氢根离子与氢离子和氢氧根离子反应;
D.NH4Fe(SO4)2在溶液中电离出铁离子,铁离子能够氧化硫离子,铁离子还能够与硫氰根离子反应生成络合物硫氰化铁.
解答 解:A.Al3+与CO32-发生双水解反应生成氢氧化铝沉淀和二氧化碳,在溶液中不能大量共存,不是生成Al2(CO3)3沉淀,故A错误;
B.Fe3+与I-之间发生氧化还原反应:2Fe3++2I-=2Fe2++I2,在溶液中不能大量共存,故B正确;
C.由水电离的c(H+)=1×10-14mol/L的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,HCO3-与氢离子和氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.NH4Fe(SO4)2的溶液中含有Fe3+,Fe3+、S2-之间发生氧化还原反应生成S单质,Fe3+、SCN-之间反应生成硫氰化铁,在溶液中不能大量共存,故D错误;
故选B.
点评 本题通过离子共存考查了性质方案的设计与评价,题目难度中等,明确离子反应发生条件为解答关键,注意掌握性质方案设计与评价的原则,试题培养了学生的分析、理解能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 该溶液中存在两个平衡、七种粒子 | |
| B. | 该溶液中K+、NH4+、NO3-、Al3+可以大量共存 | |
| C. | 滴加少量稀硫酸,充分振荡无现象 | |
| D. | 通入足量SO2气体,发生反应的离子方程式:2S2-+SO2+2H2O═3S↓+4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
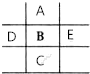 如图是元素周期表的一部分,已知A、B、C、D、E5种原子核外共有85个电子,其中只有C元素原子次外层电子数为18,则B元素是( )
如图是元素周期表的一部分,已知A、B、C、D、E5种原子核外共有85个电子,其中只有C元素原子次外层电子数为18,则B元素是( )| A. | 铝 | B. | 镁 | C. | 磷 | D. | 硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
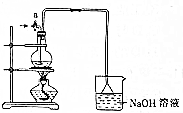 某化学探究小组为探究能与碳反应的浓硫酸的最低浓度,设计了如图实验装置进行实验.
某化学探究小组为探究能与碳反应的浓硫酸的最低浓度,设计了如图实验装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,向醋酸溶液中加入少量的水,溶液中c(H+)将增大 | |
| B. | 常温下,2NO(g)+2CO(g)═N2(g)+2CO2(g)能自发进行,则该反应的△H<0 | |
| C. | 因NaCl溶液和CH3COONH4溶液均显中性,故两溶液中水的电离程度相同 | |
| D. | 用CH3COOH溶液做导电实验,灯泡很暗,一定能证明CH3COOH是弱电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com