
(12分)
(1)若把H2O2看成是二元弱酸,请写出在水中的电离方程式:_________________________________
(2)碘也可用作心脏起搏器电源——锂碘电池的材料。该电池反应为2Li(s)+I2(s)===2LiI(s) ΔH
已知:①4Li(s)+O2(g)===2Li2O(s) ΔH1 ②4LiI(s)+O2(g)===2I2(s)+2Li2O(s) ΔH2则电池反应的ΔH=__________
(3)某温度时,在2 L容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。
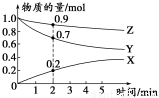
由此分析,该反应的化学方程式为___________________________________;从反应开始至2 min时,Z的反应速率为____________。
(4)在某温度时,测得0.01 mol·L-1的NaOH溶液的pH=10。在此温度下,将1mL 0.1mol/L KOH溶液加水稀释至1L,则溶液的pH为 ,若加水稀释至1000L,则溶液的pH为 。
17.(12分)(1)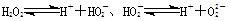 (2)1/2 (ΔH1-ΔH2)
(2)1/2 (ΔH1-ΔH2)
(3)3Y+Z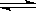 2X 0.025 mol·L-1·min-1 (4) 8 6
2X 0.025 mol·L-1·min-1 (4) 8 6
【解析】
试题分析:(1)过氧化氢是弱电解质,H2O2溶液显酸性属于二元弱酸部分电离,
电离的方程式为:H2O2?H++HO2- HO2-?H++O22-;
(2)锂碘电池的电池反应方程式可以由已知方程式(①-②)÷2得到,所以ΔH=1/2ΔH1 - 1/2ΔH2 ,
(3)由图可以看出Y、Z的物质的量随着反应的进行而逐渐减小,X的物质的量随着反应的进行“从无到有”,因此Y、Z为反应物,X为生成物,因为反应物(或生成物)的消耗量(mol)(或生成量)之比等于化学方程式对应物质的化学计量数之比,所以Δn(X)=0.2 mol-0 mol=0.2 mol;Δn(Y)=1.0 mol-0.7 mol=0.3 mol;Δn(Z)=1.0 mol-0.9 mol=0.1 mol,所以Y、Z、X三种物质的化学计量数之比为:0.3 mol∶0.1 mol∶0.2 mol=3∶1∶2,又因为由图知反应后各物质均有剩余,说明该反应是可逆反应,故上述反应的化学方程式:3X+Y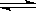 2Z;v(Z)=0.1/(2x2) =0.025 mol·L-1·min-1。
2Z;v(Z)=0.1/(2x2) =0.025 mol·L-1·min-1。
(4)该温度下,0.01mol/L NaOH溶液的pH为10,溶液中氢离子浓度为10-11mol/L,该温度下水的KW=0.01×10-10=1×10-12,根据稀释定律,1mL 0.1mol/L KOH溶液加水稀释至1L,C(OH-)=10-4mol/L, C(H+)=10-12/10-4=10-8,PH=8;若加水稀释至1000L,溶液接近中性,则溶液的pH为6。
考点:考查电离方程式的书写,盖斯定律的计算,可逆反应化学方程式的确定,化学反应速率等知识。


科目:高中化学 来源:2014-2015学年黑龙江哈尔滨第三十二中学高二上学期期中考试化学卷(解析版) 题型:填空题
(6分)下列盐溶液能发生水解的用离子方程式表示,不能发生水解的写“不发生水解”字样,并说明溶液的酸碱性
K 2CO3 , 溶液呈 性;
Na2SO4 , 溶液呈 性;
CuCl2 , 溶液呈 性。
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高一上学期期中化学试卷(解析版) 题型:选择题
(3分)对于反应3Cl2 + 6NaOH ==5NaCl + NaClO3 + 3H2O,以下叙述正确的是
A.Cl2是氧化剂,NaOH是还原剂
B.每生成1mol的NaClO3转移6mol的电子
C.Cl2既是氧化剂又是还原剂
D.被氧化的Cl原子和被还原的Cl原子的物质的量的比为5∶1
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高一上学期期中化学试卷(解析版) 题型:选择题
日本核电站泄漏物中含有放射性的53131I。有关53131I的说法不正确是
A.中子数为78 B.质子数为53
C.质量数为131 D.核外电子数是78
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高一上学期期中化学试卷(解析版) 题型:选择题
某食品袋中有一个写着“干燥剂”的小纸袋,里面的主要成分是生石灰,对此“干燥剂”的
说法正确的是
A.小纸袋中的物质可长期持续地做干燥剂
B.生石灰属于盐类
C.此干燥剂为混合物
D.其中钙元素的存在形态为游离态
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省高二上学期期中化学试卷(解析版) 题型:选择题
在密闭容器中进行反应:X2(g)+Y2(g)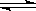 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A.Z为0.3 mol·L-1 B.Y2为0.4 mol·L-1
C.X2为0.2 mol·L-1 D.Z为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省高二上学期期中化学试卷(解析版) 题型:选择题
在CH3COOH溶液中存在如下平衡:CH3COOH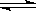 H++CH3COO-。加入少量下列固体物质,能使平衡逆向移动的是
H++CH3COO-。加入少量下列固体物质,能使平衡逆向移动的是
A.CH3COONa B.NaCl C.Na2CO3 D.NaOH
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高一上学期期中考试化学试卷(解析版) 题型:选择题
由相同条件下的三个反应:①2NaA +B2 =2NaB +A2; ②2NaC +A2 =2NaA +C2;
③2NaB +D2 =2NaD +B2;可判断
A.氧化性:A2>B2>C2>D2
B.还原性:C->A->B->D-
C.2NaD +A2 =2NaA +D2可进行
D.2NaC+B2 =2NaB+C2不能进行
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省宁波市高一上学期期中化学试卷(解析版) 题型:选择题
将一定质量的钠、钾投入一定量的稀盐酸中,产生的气体随时间变化的曲线如图所示,则下列说法中正确的是
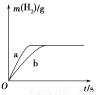
A.投入的Na、K一定等质量
B.投入的Na的质量小于K的质量
C.曲线a为Na,b为K
D.稀盐酸的量一定是不足量的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com