
 乳酸(2-羟基丙酸)为无色液体,与水混溶,弱挥发性.它在多种生物化学过
乳酸(2-羟基丙酸)为无色液体,与水混溶,弱挥发性.它在多种生物化学过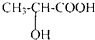
| 次数 | 1 | 2 | 3 | 4 |
| 滴定体积(mL) | 19.22 | 19.18 | 19.80 | 19.20 |
分析 实验(一):(1)根据步骤1:得到500mL原液可知,仪器A是500mL容量瓶;
(2)乳酸与氢氧化钠恰好反应时生成乳酸钠,乳酸钠呈碱性,用酚酞作指示剂,酚酞在酸性溶液中显无色,在碱性溶液中显浅红色;滴定时,当滴至待测液变色且半分钟不恢复即为滴定终点;
(3)根据数据记录表数据分析,第三组数据误差大,为错误记录,不能作为有效数据,根据题干中其余三组数据计算消耗的氢氧化钠溶液体积的平均值,乳酸的产率=$\frac{实际产量}{理论产量}$×100%,根据质量守恒,14.40g葡萄糖理论产出乳酸14.40g;
实验(二):
(4)证明乳酸为弱酸,可证明存在电离平衡、部分电离以及对应的强碱盐的溶液的酸碱性等角度设计实验;
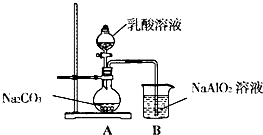
(5)①偏铝酸钠可以和少量二氧化碳反应生成氢氧化铝沉淀和碳酸钠;偏铝酸钠可以和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,现象是溶液出现白色浑浊;
②乳酸(2-羟基丙酸)为无色液体,与水混溶,易挥发,需排除乳酸的干扰.
解答 解:实验(一):(1)根据步骤1:过滤,将滤液转移到仪器A中,定容,得到500mL原液,说明仪器A为500mL容量瓶,
故答案为:500mL容量瓶;
(2)取20.00mL原液于锥形瓶中,加入酚酞作指示剂,用浓为0.1000mol/L的NaOH溶液滴定至终点,乳酸与氢氧化钠恰好反应时生成乳酸钠,乳酸钠呈碱性,酚酞在酸性溶液中显无色,在碱性溶液中显浅红色,所以判断已到达滴定终点为:当滴入最后一滴标准液时,锥形瓶中无色溶液变红色,且半分钟内不褪色,
故答案为:当滴入最后一滴标准液时,锥形瓶中无色溶液变红色,且半分钟内不褪色;
(3)根据数据记录表数据分析,第三组数据误差大,为错误记录,不能作为有效数据,所以消耗的氢氧化钠溶液的体积为:$\frac{19.22+19.18+19.20}{3}$=19.20mL,20.00mL原液中,n(乳酸)=n(NaOH)=CV=0.1000mol/L×19.20×10-3L=1.92×10-3mol,实际生产乳酸的质量为:m=nM=1.92×10-3mol×$\frac{500}{20}$×90g/mol=4.32g,
根据质量守恒,14.40g葡萄糖理论产出乳酸14.40g,所以乳酸的产率=$\frac{实际产量}{理论产量}$×100%=$\frac{4.32g}{14.4g}$×100%=30%,
故答案为:30%;
实验(二):(4)证明乳酸为弱酸,可证明存在电离平衡,取0.1mol/L乳酸溶液于烧杯中,用PH计测定其PH值,若PH大于1,说明乳酸是弱酸,或取PH=a乳酸溶液于烧杯中,加水稀释10n倍,用PH计测定其PH值,若PH小于a+n说明乳酸是弱酸,测定该酸的钠盐溶液常温下的pH,若pH>7,说明为强碱弱酸盐,水解呈碱性,可说明为弱酸,常温下取0.1mol/L乳酸钠溶液于烧杯中,用pH计测定其PH值,若PH大于7,说明乳酸是弱酸,
故答案为:取0.1mol/L乳酸溶液于烧杯中,用PH计测定其PH值,若PH大于1,说明乳酸是弱酸或(常温下取0.1mol/L乳酸钠溶液于烧杯中,用pH计测定其PH值,若PH大于7,说明乳酸是弱酸)或(取PH=a乳酸溶液于烧杯中,加水稀释10n倍,用PH计测定其PH值,若PH小于a+n说明乳酸是弱酸);
(5)①偏铝酸钠可以和少量二氧化碳反应生成氢氧化铝沉淀和碳酸钠,反应的方程式为2NaAlO2+3H2O+CO2═2Al(OH)3↓+Na2CO3,
偏铝酸钠可以和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,即NaAlO2+2H2O+CO2═Al(OH)3↓+NaHCO3,可观察到烧杯中的现象是溶液出现白色浑浊,
故答案为:溶液出现白色浑浊;2NaAlO2+3H2O+CO2═2Al(OH)3↓+Na2CO3或NaAlO2+2H2O+CO2═Al(OH)3↓+NaHCO3;
②乳酸(2-羟基丙酸)为无色液体,与水混溶,易挥发,需在A与B之间增加一个装有碳酸氢钠溶液的洗气瓶,洗去二氧化碳中的乳酸,排除乳酸的干扰,
故答案为:在A与B之间增加一个装有碳酸氢钠溶液的洗气瓶.
点评 本题考查乳酸的性质实验,侧重于学生的分析能力和实验能力的考查,注意把握实验的角度和可行性的评价,明确弱电解质的判断方法,题目难度中等.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙醚分子式均为C2H6O,二者互为同分异构体 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 乙醛、葡萄糖均能发生银镜反应,两者分子中均含有醛基 | |
| D. | 乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
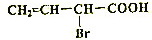 ,试回答:
,试回答: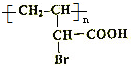 ;
;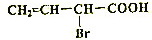 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$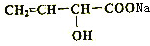 +NaBr+H2O;
+NaBr+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸 纯碱 硫酸钙 | |
| B. | 氢氯酸 烧碱 硫酸亚铁 | |
| C. | 碳酸 乙醇 烧碱 | |
| D. | 磷酸 熟石灰 苛性钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2 | B. | NaOH | C. | HCl | D. | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释后溶液的pH=9 | |
| B. | 稀释过程中,溶液中所有离子的浓度均减小 | |
| C. | 稀释后溶液中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ 减小 | |
| D. | 该氨水稀释前后中和盐酸的能力相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com