
自然界中存在的碘的稳定性核素是碘-127(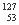 I)。日本福岛第一核电站事故释放出的放射性物质中,含有人工放射性核素碘-131(
I)。日本福岛第一核电站事故释放出的放射性物质中,含有人工放射性核素碘-131(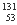 I) 。碘-131 (
I) 。碘-131 (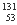 I) 一旦被人体吸入,就可能会引发甲状腺疾病。对于这两种核素的下列说法正确的是
I) 一旦被人体吸入,就可能会引发甲状腺疾病。对于这两种核素的下列说法正确的是
A.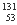 I是一种新元素 B.
I是一种新元素 B. 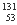 I的摩尔质量为131g
I的摩尔质量为131g
C.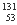 I和
I和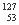 I互为同位素 D.
I互为同位素 D. 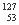 I中子数与质子数之差为74
I中子数与质子数之差为74
科目:高中化学 来源: 题型:
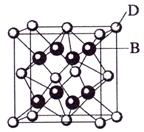 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图。
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图。
⑴ A的元素符号是 ;E在元素周期表中的位置是 ,它的+2价离子的电子排布式为
⑵ B的氢化物的晶体类型是 晶体,B的氢化物与C的氢化物相比,分子极性较大的是 (写化学式)。
⑶ 从图中可以看出,D跟B形成的离子化合物的电子式为 ;该离子化合物晶体的密度为ag·cm-3,则晶胞的体积是 (只要求列出算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
火法炼铜首先要焙烧黄铜矿,反应为:CuFeS2+O2 Cu2S+FeS+SO2 则下列说法正确的是
Cu2S+FeS+SO2 则下列说法正确的是
A.CuFeS2既是氧化剂又是还原剂,硫元素既被氧化又被还原
B.每生成1molSO2转移6mol电子
C.SO2既是氧化产物又是还原产物,FeS只是还原产物
D.每转移1.2 mol电子,有0.3 mol氧气被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为长式周期表的一部分,其中的序号代表对应的元素。
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ||||||||||||||||
|
| ⑨ | ⑩ |
(1)写出上表中元素⑨原子的外围电子排布式__________。
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为__________杂化;元素⑦与⑧形成的化合物的晶体类型是__________。
(3)元素④的第一电离能__________元素⑤(填写“>”“=”或“<”)的第一电离能;元素④与元素①形成的最简单的X分子的空间构型为__________。请写出与元素④的单质互为等电子体分子、离子的化学式__________(各写一种)。
(4)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是__________。
(5)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为__________。
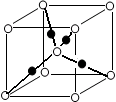
(6)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,反应的离子方程式为__________;元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则一个晶胞中所包含的氧原子数目为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在周期表中短周期主族元素X、Y、Z、W,它们的原子序数依次增大。X与Z同主族,X与Z的原子序数之和为24。W原子的最外层电子数比Y原子的最外层电子数多2个。下列叙述正确的是
A.气态氢化物的稳定性 Y>X B.最高价氧化物的水化物酸性 Y>Z
C.Z的氧化物不止一种 D.原子半径 Z>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
写出下列有关化学方程式或离子方程式:
(1)乙烯在催化剂存在条件下与水反应: ;
(2)在一定条件下,乙炔与氯化氢以物质的量之比1:1反应: ;
(3)苯和浓硝酸浓硫酸的混合液在50℃~60℃发生反应: ;
(4)Na2CO3溶液呈碱性的原因(用离子方程式表示): ;
(5)SO2和Cl2按1∶1同时通入到品红溶液中,结果发现品红溶液不褪色。用离子方程式表示产生该现象的原因: ;
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,某固态化合物X受热分解的反应为:2XA↑+B↑+2C↑,测得反应后生成的混合气体的密度是同温同压下H2密度的12倍,则X的摩尔质量是( )
A.24g/mol B.48g/mol C.80g/mol D.96g/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com