
 ;V原子的结构示意图
;V原子的结构示意图 ;Z的氢化物结构式为
;Z的氢化物结构式为 ;写出U元素在周期表中的位置第三周期第VIA族N2W2中含有的化学键的种类离子键、共价键
;写出U元素在周期表中的位置第三周期第VIA族N2W2中含有的化学键的种类离子键、共价键分析 X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大,Y原子的L层电子数是K层电子数的2倍,则Y核外电子数为2+4=6,所以Y是C元素;Z、W的单质常温下均为无色气体,且原子序数大于Y,所以Z是N元素、W是O元素;X与N同主族,且与W(氧)都能形成A2B、A2B2型化合物,X原子序数小于N,则X是H元素、N是Na元素;U原子的最外层电子数是其电子层数的2倍,其最外层电子数是6,且原子序数大于11,所以U是S元素;V是短周期主族元素,其原子序数大于U(硫),所以V是Cl元素,据此解答.
解答 解:X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大,Y原子的L层电子数是K层电子数的2倍,则Y核外电子数为2+4=6,所以Y是C元素;Z、W的单质常温下均为无色气体,且原子序数大于Y,所以Z是N元素、W是O元素;X与N同主族,且与W(氧)都能形成A2B、A2B2型化合物,X原子序数小于N,则X是H元素、N是Na元素;U原子的最外层电子数是其电子层数的2倍,其最外层电子数是6,且原子序数大于11,所以U是S元素;V是短周期主族元素,其原子序数大于U(硫),所以V是Cl元素.
(1)CO2的电子式为 ;V是Cl元素,其原子核外有3个电子层、最外层电子数是7,则Cl原子的结构示意图为
;V是Cl元素,其原子核外有3个电子层、最外层电子数是7,则Cl原子的结构示意图为 ;Z是N元素,氮元素氢化物的结构式为
;Z是N元素,氮元素氢化物的结构式为 ;U是S元素,S元素在周期表中的位置是第三周期第VIA族;Na2O2中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在共价键,所以过氧化钠中含有的化学键有离子键和共价键,
;U是S元素,S元素在周期表中的位置是第三周期第VIA族;Na2O2中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在共价键,所以过氧化钠中含有的化学键有离子键和共价键,
故答案为: ;
; ;
; ;第三周期第VIA族;离子键和共价键;
;第三周期第VIA族;离子键和共价键;
(2)H、C、N、O四种元素(按顺序)可组成原子个数比为5:1:1:3的化合物为NH4HCO3,该化合物的稀溶液与足量澄清石灰水反应离子方程式为:NH4++HCO3-+Ca2++2OH-=NH3.H2O+CaCO3↓+H2O,
故答案为:NH4++HCO3-+Ca2++2OH-=NH3.H2O+CaCO3↓+H2O;
(3)SO2与氯气在水溶液中发生氧化还原反应生成盐酸和硫酸,化学方程式是:SO2+Cl2+2H2O=2HCl+H2SO4,
故答案为:SO2+Cl2+2H2O=2HCl+H2SO4.
点评 本题考查位置结构性质的相互关系及应用,推断元素是解题关键,需要学生熟练掌握元素化合物知识,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 28gN2与足量氢气反应,转移电子的数目为6NA | |
| B. | 标准状况下,11.2LHF含有的分子数为0.5NA | |
| C. | 标准状况下,22.4L14CO2与44g14CO2所含分子数均为NA | |
| D. | 2L0.2mol•L-1的稀硝酸与适量铁恰好反应(还原产物只有NO),生成NO的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含有1个双键的环状有机物 | B. | 含2个双键的链状有机物 | ||
| C. | 环状有机物 | D. | 含一个三键的链状有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
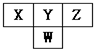 如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )
如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )| A. | 原子半径的大小顺序是W>Y>Z | |
| B. | X的氢化物没有Z的氢化物稳定 | |
| C. | Z元素的最高价氧化物的水化物的酸性最强 | |
| D. | Y的氢化物比W的氢化物沸点高,是因为分子间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 炼铁的还原剂CO是由焦炭和CO2反应而得,现将焦炭与CO2放入体积为2L的密闭容
炼铁的还原剂CO是由焦炭和CO2反应而得,现将焦炭与CO2放入体积为2L的密闭容| A. | 3min时温度由T1升高到T2,则Q>0,重新平衡时K(T2):K(T1)=14﹕3 | |
| B. | 当容器内的压强不变时,该反应一定达到平衡状态,且$\frac{P(平衡)}{P(开始)}$<1 | |
| C. | 0~1min,v(CO)=1mol/(L•min);1~5min时,v正(CO)=v逆(CO2) | |
| D. | 5min时再充入一定量的CO,a、d曲线分别表示n(CO)、n(CO2)的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com