


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
(16分)黄铁矿的主要成分是FeS2。测定黄铁矿中FeS2含量的两种方法如下图所示:
已知:①王水是由1体积的浓硝酸(ρ=1.42g·cm-3)和3体积的浓盐酸(ρ=1.19g·cm-3)混合而成的。
②黄铁矿和王水反应的方程式为FeS2+5HNO3+3HCl=FeCl3+2H2SO4+5NO↑+2H2O
请回答下列问题:
(1)简述实验室配制王水的操作过程_____________________________________
________________________________________________________________。
(2)方法一中过滤、洗涤、灼烧都用到的仪器是_______________。
(3)方法二中要判断BaCl2溶液是否过量,可向滤液中加入X溶液,X可以是_________(填代号)
A.BaCl2 B.NaOH C.Na2SO4 D.HCl
(4)实验室利用下列装置和试剂制取少量氯化氢气体试剂:①浓硫酸 ②浓盐酸 ③食盐固体
若选用试剂①③,则应选择的装置是___________(填代号,下同);推测发生反应的化学方程式为__________________________________________________;
若选用试剂①②,则宜选择的装置是____________。
(5)方法一中,灼烧时发生反应的化学反应方程式为________________________;已知称取黄铁矿样品的质量为1.50g,称得灼烧后固体的质量为0.8g,不考虑操作误差,则该矿石中FeS2的质量分数是________________。
查看答案和解析>>
科目:高中化学 来源:2011届江苏省苏北四市高三第二次调研考试化学试卷 题型:填空题
(12分)从废钯催化剂(该催化剂的载体为 活性炭,杂质元素有铁、镁、铝、硅、铜等)中提取海棉钯(含Pd>99.9%)的部分工艺流程如下:
活性炭,杂质元素有铁、镁、铝、硅、铜等)中提取海棉钯(含Pd>99.9%)的部分工艺流程如下: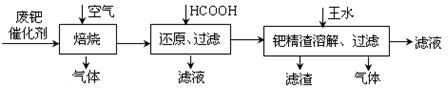
将最后所得到的滤液,经过一定的操作后可得到海棉钯。
(1)废钯催化剂经烘干后,再在800℃的高温下焙烧,焙烧过程中需通入足量空气的原因是 ▲ ;焙烧时钯转化为氧化钯(PdO),则甲酸还原氧化钯的化学方程式为 ▲ 。
(2)钯精渣中钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如图1~图3所示,则王水溶解钯精渣的适宜条件为 ▲ 、 ▲ 、 ▲ 。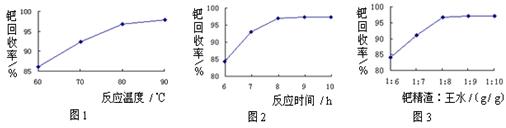
(3)王水是浓硝酸与浓盐酸按体积比1∶3混合而成的,王水溶解钯精渣的过程中有化合物A和一种无色、有毒气体B生成,并得到滤渣。
①气体B的分子式: ▲ ;滤渣的主要成分是 ▲ 。
②经测定,化合物A由3种元素组成,有关元素的质量分数为Pd:42.4%,H:0.8%,则A的化学式为 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省南昌市高三第三次模拟测试理综化学部分 题型:填空题
从废钯催化剂(该催化剂的载体为活性炭,杂质元素有铁、镁、铝、硅、铜等)中提取海棉钯(含Pd>99.9%)的部分工艺流程如下:
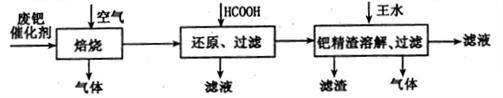
将最后所得到的滤液,经过一定的操作后可得到海棉钯。
(1)废钯催化剂经烘干后,再在800℃的高温下焙烧,焙烧过程中需通入足量空气的原因是 ;焙烧时钯转化为氧化钯(Pd0),则甲酸还原氧化钯的化学方程式为
。
(2)钯精渣中钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王 水用量对钯回收率的影响如图l~图3所示,则王水溶解钯精渣的适宜条件为 、 、 。
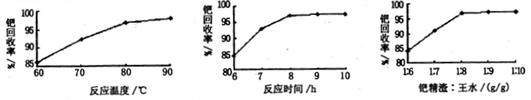
(3)王水是浓硝酸与浓盐酸按体积比1:3混合而成的,王水溶解钯精渣的过程中有化合物A和一种无色、有毒气体B生成,并得到滤渣。
①气体B的分子式: ;滤渣的主要成分是 。
②经测定,化合物A由3种元素组成,有关元素的质量分数为Pd:42.4%,H:0.8%,则A的化学式为 。(已知Pd相对原子质量为106)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省日照市高三第一次模拟考试(理综)化学部分 题型:填空题
(12分)美日科学家因研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖。有机合成常用的钯/活性炭催化剂长期使用,催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,故需对其回收再利用。一种由废催化剂制取氯化钯(PdCl2)的工艺流程如下:
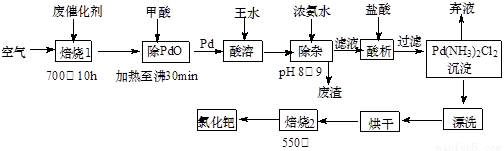
(1)甲酸在反应中的作用是 (选填:“氧化剂”或“还原剂”);
(2)加浓氨水时,钯元素转变为可溶性[Pd(NH3)4]2+,此时铁元素的存在形式是 (写化学式);
(3)王水是浓硝酸与浓盐酸按体积比1∶3混合而成的,钯在王水中溶解的过程中有化合物A和一种无色、有毒气体B生成。
① 气体B的化学式为 ,
② 经测定,化合物A由3种元素组成,有关元素的质量分数为Pd:42.4%,H:0.8%。则A的化学式为 ;
(4)700℃“焙烧1”的目的是 ,550℃“焙烧2”的目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com