
下列实验装置设计正确、且能达到目的的是

Ⅰ Ⅱ Ⅲ Ⅳ
A.实验I:可用于吸收氨气,并能防止倒吸
B.实验Ⅱ:静置一段时间,小试管内有晶体析出
C.实验III:配制一定物质的量浓度的稀硫酸
D.实验Ⅳ:回收利用碘的CCl4 溶液中的有机溶剂
科目:高中化学 来源:2013-2014浙江省杭州市高二年级教学质量检测模拟卷化学试卷(解析版) 题型:填空题
(5分)氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家。
(1)右图表示温度为T K时氮气与氢气合成氨反应过程中的能量变化, 写出该反应的热化学方程式 。

(2)已知在TK温度下合成氨反应在2.00L的密闭容器中进行。得到如下数据:
时间(h) 物质的量(mol) |
| 0 | 1 | 2 | 3 | 4 |
N2 |
| 1.50 | n1 | 1.20 | n3 | 1.00 |
H2 |
| 4.50 | 4.20 | 3.60 | n4 | 3.00 |
NH3 |
| 0.00 | 0.20 | n2 | 1.00 | 1.00 |
根据表中数据计算:
①0~1h内N2的平均反应速率为 mol/(L·h)。
②反应进行到2h时放出的热量为 kJ。
③此条件下,反应:N2 + 3H2  2NH3 的化学平衡常数K = (保留两位小数)。
2NH3 的化学平衡常数K = (保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1mol,化学平衡移动的方向是 (填“正反应”或“逆反应”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
已知:还原性强弱:I― >Fe2+。往100 mL碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
A.1.1mol·L-1 B.1.5mol·L-1 C.1.2mol·L-1 D.1.0mol·L-1
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高一下学期期末考试化学试卷(解析版) 题型:填空题
将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2体积(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解)。试计算:(无需书写计算步骤)

(1)盐酸的物质的量浓度为 mol/L。
(2)该样品中NaOH与Na2CO3物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性溶液中可以发生反应产生Cl2,下列关于混盐CaOCl2的有关判断不正确的是(NA为阿伏加德罗常数)
A.该混盐在酸性溶液中产生1mol Cl2时转移的电子数为NA
B.该混盐的水溶液具有漂白性
C.该混盐中氯元素的化合价为+1和-1价
D.该混盐具有较强的还原性
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列关于硅单质及其化合物的说法正确的是
 ①硅是构成一些岩石和矿物的基本元素
①硅是构成一些岩石和矿物的基本元素 ②水泥、玻璃、水晶饰物都是硅酸盐制品
②水泥、玻璃、水晶饰物都是硅酸盐制品
 ③高纯度的硅单质广泛用于制作光导纤维
③高纯度的硅单质广泛用于制作光导纤维  ④陶瓷是人类应用很早的硅酸盐材料
④陶瓷是人类应用很早的硅酸盐材料
 A.①② B.②③ C.①④ D.③④
A.①② B.②③ C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省宁波市高二下学期期末考试化学试卷(解析版) 题型:实验题
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验Ⅰ:反应产物的定性探究。
实验装置如图所示:(固定装置已略去)
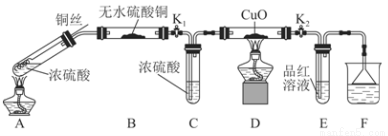
(1)A中反应的化学方程式为 。
(2)F烧杯中的溶液通常是 。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
实验Ⅱ:反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:
硫酸/mol·L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
15 | 约150 | 约236 |
16 | 约140 | 约250 |
18 | 约120 | 不消失 |
资料2:X-射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。仅由上述资料可得出的正确结论是 __。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15 mol/L
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol/L Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为 _。(已知:2Cu2++4I-===2CuI+I2,2S2O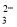 +I2===S4O
+I2===S4O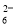 +2I-)
+2I-)
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省宁波市高二下学期期末考试化学试卷(解析版) 题型:选择题
化学上用“示踪原子法”来判断反应的历程,下列用“示踪原子法”表示的化学方程式正确的是 ( )
A.5H218O2+2KMnO4+3H2SO4===518O2↑+K2SO4+2MnSO4+8H2O
B.CH3COOH+C2H518OH→CH3COOCH2CH3+H218O
C.2Na2O2+2H218O===4NaOH+18O2↑
D.K37ClO3+6HCl===K37Cl+3Cl2↑+3H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省台州市路桥区高考理综化学模拟试卷一试卷(解析版) 题型:实验题
(14分)草酸是一种重要的化工原料,广泛用于药物生产、高分子合成等工业,草酸晶体受热到100℃时失去结晶水,成为无水草酸。某学习小组的同学拟以甘蔗渣为原料用水解—氧化—水解循环进行制取草酸。
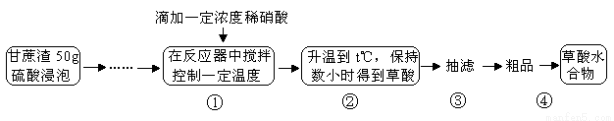

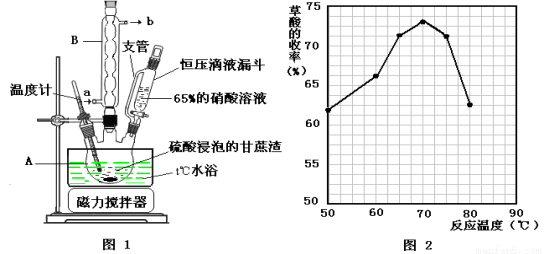
请跟据以上信息回答下列问题:
(1)图示①②的氧化—水解过程是在上图1的装置中进行的,指出装置A的名称 。
(2)图示①②的氧化—水解过程中,在硝酸用量、反应的时间等条件均相同的情况下,改变反应温度以考察反应温度对草酸收率的影响,结果如上图2所示,请选择最佳的反应温度为 ,为了达到图2所示的温度,选择图1的水浴加热,其优点是 。
(3)在图示③④中的操作涉及到抽滤,洗涤、干燥,下列有关说法正确的是 。
A.在实验过程中,通过快速冷却草酸溶液,可以得到较大的晶体颗粒,便于抽滤
B.在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物
C.为了检验洗涤是否完全,应拔下吸滤瓶与安全瓶之间橡皮管,从吸滤瓶上口倒出少量滤液于试管中进行相关实验。
D.为了得到干燥的晶体,可以选择在坩埚中直接加热,并在干燥器中冷却。
(4)要测定草酸晶体(H2C2O4·2H2O)的纯度,称取7.200g制备的草酸晶体溶于适量水配成250mL溶液,取25.00mL草酸溶液于锥形瓶中,用0.1000mol/L酸性高锰酸钾溶液滴定
(5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O),
①取25.00mL草酸溶液的仪器是 ,
②在草酸纯度测定的实验过程中,下列说法正确的是: 。
A.润洗滴定管时,应从滴定管上口加满所需的酸或碱液,使滴定管内壁充分润洗
B.移液管取草酸溶液时,需将尖嘴处的液体吹入锥形瓶,会使实验误差偏低
C.滴定时,左手轻轻向内扣住活塞,手心空握以免碰到活塞使其松动漏出溶液
D.滴定终点读取滴定管刻度时,仰视标准液液面,会使实验误差偏高
③判断滴定已经达到终点的方法是: 。
④达到滴定终点时,消耗高锰酸钾溶液共20.00mL,则草酸晶体的纯度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com