
【题目】下列物质中既含有离子键又含有共价键的是
A.CaCl2B.H2SO4C.NaOHD.H2O2
科目:高中化学 来源: 题型:
【题目】如图所示虚线内字母表示相应元素,而A~C表示大分子物质,a~d表示小分子物质,其中a~c是相应大分子的基本组成单位.回答以下问题:

(1)图中a是_____,与A为同类化合物,属于动物细胞中储能物质的是_____。
(2)c在人体细胞中共有_____种,C分子彻底水解的产物有_____种。
(3)d指的是______;与d为同类化合物的性激素能促进人和动物_____的发育以及_____的形成。
(4)物质B的分子结构的多样性主要是由b的_____决定的。在物质b中,人体内细胞中不能合成、需要从食物中获取的b叫做_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 常温常压下,48g O2和O3的混合气体中含有氧原子数为3NA
B. 17 g氨气所含质子数目为11NA
C. 标准状况下22.4L的四氯化碳,含有四氯化碳分子数为NA
D. 物质的量浓度为0.5 mol·L-1的MgCl2溶液中,含有Cl-个数为1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3 mol NH3分子中所含原子数_____ ,质量是____,标准状况下的体积是____。
(2)含有0.4 mol Al3+的Al2(SO4)3溶液中所含SO42-的物质的量是______。
(3)等质量的SO2和SO3中, 硫原子个数之比为____,氧原子个数之比_______。
(4)配制100 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O质量为__________ ;0.5L0.5mol/L FeCl3溶液中的Cl-的物质的量浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气的主要成分是 一氧化碳和氢气,是重要的化工原料。
I.已知下列反应:
①CH4(g) + H2O(g)![]() CO(g) + 3H2(g) ΔH = +206 kJ/mol
CO(g) + 3H2(g) ΔH = +206 kJ/mol
②C(s) + H2O(g) = CO(g) + H2(g) ΔH = +131 kJ/mol
(1)工业制取炭黑的方法之一是将甲烷隔绝空气加热到1300℃进行裂解。填写空白。
CH4(g)= C(s)+ 2H2(g) ΔH =______________kJ/mol。
(2)若800℃时,反应①的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=4.0 mol·L-1;c(H2O)=5.0 mol·L-1;c(CO)=1.5 mol·L-1;c(H2)=2 mol·L-1,则此时该可逆反应的状态是_____________________(填“达到平衡”、“向正反应方向移动”或“向逆反应方向移动”)。
Ⅱ.甲醇是一种可再生能源,工业上用合成气来合成甲醇:CO(g)+2H2(g)![]() CH3OH(g),分析该反应并回答下列问题:
CH3OH(g),分析该反应并回答下列问题:
(3)一定条件下,将CO与H2以物质的量之比1:1置于恒容密闭容器中发生以上反应,能说明该反应已达到平衡的是_____________________________。
A.体系的压强不发生变化 B.混合气的密度保持不变
C.体系中碳元素的质量分数不变 D.CO与H2的物质的量之比保持不变
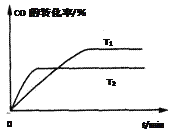
(4)如图是该反应在不同温度下CO的转化率随时间变化的曲线。T1和T2温度下的平衡常数大小关系是K1______K2 (填“>”、“<”或“=”)。理由是__________________________________________________。
(5)已知甲醇燃料电池的工作原理如图所示。该电池工作时,电池左边的电极发生的电极反应式为______________________________。
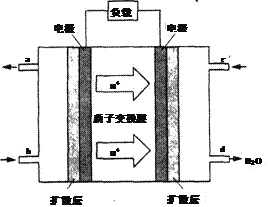
(6)用甲醇燃料电池作为直流电源,设计如图装置制取Cu2O,电解总反应为:2Cu+H2O=Cu2O+H2↑。写出铜电极的电极反应式_______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaCl2·xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2·xH2O,工艺流程如下图所示。
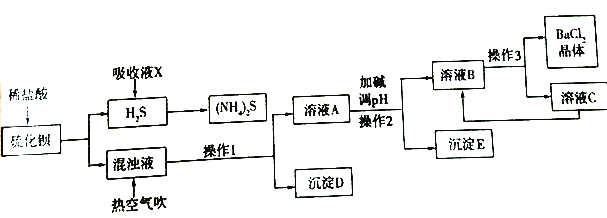
已知:室温时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]= 4.0×10-38
请回答下列问题:
(1)写出氯化钡的电子式________。盐酸和硫化钡反应的化学方程式为________。
(2)吸收液X的溶质是________。一定条件下向(NH4)2S溶液中通入空气,可得到单质硫并使吸收液再生,吸收液再生反应的化学方程式为________。
(3)操作1的名称是________,操作3的过程是将容液B蒸发浓缩、________、过滤等。
(4)沉淀D的成分是________。
(5)热空气吹除时会有部分HS-转变为S2O32-,使产品仍达不到纯度要求,可再进行酸化脱硫,酸化脱硫时的离子方程式为________。
(6)室温时,若加碱调溶液pH至9,则完全沉淀的离子是________ 。
(7)此工艺流程中循环利用的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A. 2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol![]()
B. 2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+1/2O2(g) == H2O(1) △H= ―285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图是该有机物的质谱图,则其相对分子质量为________。
(2)分子式为C3H6O2的有机物,如果在核磁共振氢谱图上观察到氢的原子给出的峰有两种情况:第一种情况峰的强度比为1∶1,请写出其对应化合物的结构简式_____;第二种情况峰的强度比为3∶2∶1,请写出该化合物可能的结构简式__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.伴随能量变化的物质变化也一定是化学变化
B.有化学键变化的一定发生了化学反应
C.化学键断裂时放出能量
D.因为3O2=2O3是吸热反应,所以臭氧比氧气的化学性质更活泼
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com