
【题目】下列有关叙述正确的是
A. NH3可用作制冷剂 B. 过氧化氢有氧化性,不能用于人体消毒
C. S的氧化性比Cl2的氧化性强 D. 电解饱和食盐水制备金属钠
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂。某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用下图所示的装置制备NCl3,并探究NCl3的漂白性。
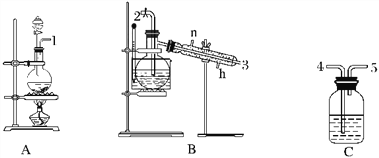
NCl3的相关性质如下:
物理性质 | 制备原理 | 化学性质 |
黄色油状液体,熔点为-40 ℃,沸点为71 ℃,不溶于冷水,易溶于有机溶剂,密度为1.65 g·mL-1 | Cl2与NH4Cl水溶液在低温下反应 | 95 ℃爆炸,热水中能与水反应 |
回答下列问题:
(1)根据实验目的,接口连接的顺序为1→____________________________________。
(2)C装置作用是_________________________________________________________________。
(3)B装置中发生反应的化学方程式为____________________________________,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为________________。
(4)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50~60 ℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,写出有关化学反应方程式并解释实验现象:___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
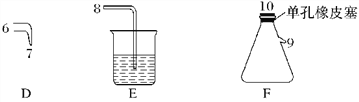
【题目】如图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。

已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气的体积比的方法是_____________________________________。
②使用多孔球泡的作用是__________________________________________。
(2)①装置B中产生Cl2O的化学方程式为__________________________________________。
②若B无冷却装置,进入C中的Cl2O会大量减少。其原因是___________________________。
(3)装置C中采用棕色圆底烧瓶是因为______________________________________________。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中所得次氯酸溶液的物质的量浓度的实验方案:用_________量取20.00 mL次氯酸溶液于烧杯中,_________________________________________________________________________________________________________。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。除常用仪器外须使用的仪器有:电子天平,真空干燥箱)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作的叙述中,正确的是
A. 用苯萃取碘水时,有机层从分液漏斗下口放出
B. 制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中
C. 用50mL的量筒量取6.80mL盐酸
D. 中和滴定实验中,眼睛应注视锥形瓶内溶液颜色的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于锌铜—稀硫酸原电池的叙述,正确的是( )
A. 氢离子在铜表面被氧化,产生气泡
B. 溶液中的阴离子SO42-移向负极
C. 电子经导线从负极流向正极,再经溶液从正极流向负片
D. 金属铜参与了电极反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
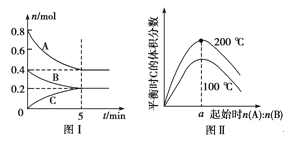
A.图Ⅱ所知反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
B.200 ℃时,反应从开始到平衡的平均速率v(B)=0.02 mol·L-1·min-1
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He的瞬间,v正>v逆
D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数等于0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是( )
A. 亚硝酸盐被还原 B. 维生素C是还原剂
C. 维生素C将Fe3+还原为Fe2+ D. 亚硝酸盐与一氧化碳使人中毒的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,一定浓度的某溶液,由水电离出的c(OH-)=1.O×10-4mol·L-1,则该溶液中的溶质可能是
A. Na2SO4 B. CH3COONa C. Na0H D. KHSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com