
��16�֣��������ʼ��仯�����빤ũҵ�������ճ����������е���ϵ����ش��������⣺
��2��һ���¶��£�������������һ����̼�������·�Ӧ��
�ٸ��¶�ʱ����2 Lʢ��Fe2O3��ĩ���ܱ�������ͨ��CO���壬5 min�������˵�����11.2 g�������ʱ����CO�ķ�Ӧ����Ϊ ��
�ڴ�ƽ������¶����ߣ���ֵ������Q 0���>������=������<������
��3����ҵ�����ݽ������������������ܽ�Ȳ�ͬ��ͨ��������Һ��pH���ﵽ����������ӵ�Ŀ�ġ��������ܽ��������������ڲ�ͬpH�µ��ܽ������s/mol��L-1������Ҫ��ȥCuCl2��Һ������Fe3+��Ӧ������Һ��pHΪ ������ţ��� 
A����l B��4���� C������6 D������9
��4��ij��ҵ��ˮ�к���Cu2+��Pb2+��Hg2+������ҵ��ˮ�м��������FeS����FeS��CuS��PbS��HgS����ʱ����Һ��c��Fe2+����c��Pb2+����c��Hg2+��= �� �� ��
��֪��Ksp��FeS��=6.3��10-18mol2��L-2��Ksp��PbS��=3.4��10-28mol2��L-2
Ksp��CuS��=1.3��10-36mol2��L-2��Ksp��HgS��=6.4��10-53mol2��L-2
��5������������ԭ��Ӧ��Cu2+��aq��+Fe��s��===Fe2+��aq��+Cu��s����Ƴ���ͼ��ʾ��ԭ��أ�����ڸõ��װ�õ�˵���в���ȷ���� ������ţ���
A���缫X�IJ�����Fe
B���������ҺY��AgNO3��Һ
C��ԭ��ع���ʱ�������е������Ӳ���������ص��Ȼ�����Һ��
D��ԭ��ع���ʱ��x�缫��ӦΪ��O2+2H2O+4e-��4OH-

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�� | Ԫ�����ʼ������Ϣ |
| A | �䵥�ʵ�һ�־����䲻�ǽ������壬���ǵ�������壬�����ۡ������������ԣ�����������е����������������ܺ͵缫���ϣ� |
| B | �䵥������ǿ�ᡢǿ����Һ��Ӧ���������ڵ������ڵ����������а뾶��С�� |
| C | �ǵ����ʵ����Ԫ��֮һ��ԭ�Ӻ�����3�ֲ�ͬ�����ĵ��ӣ���δ�ɶԵ�������࣮ |
| D | ԭ�Ӻ������������Ų�Ϊnsnnp2n+1�� |


 NH 3?H2O
NH 3?H2O NH4++OH-
NH4++OH- NH 3?H2O
NH 3?H2O NH4++OH-
NH4++OH-�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| [CO] | [CO2] |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ʼ��仯�����빤ũҵ�������ճ����������е���ϵ����ش��������⣺

��2��һ���¶��£�������������һ����̼�������·�Ӧ��

�ٸ��¶�ʱ����2 Lʢ��Fe2O3��ĩ���ܱ�������ͨ��CO���壬5 min�������˵�����11.2 g�������ʱ����CO�ķ�Ӧ����Ϊ ��
�ڴ�ƽ������¶����ߣ���ֵ������Q 0���>������=������<������
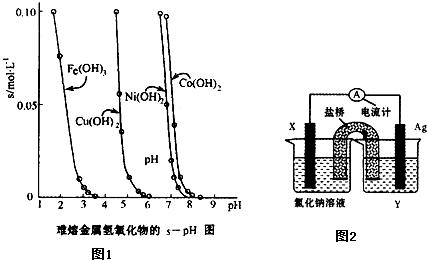
��3����ҵ�����ݽ������������������ܽ�Ȳ�ͬ��ͨ��������Һ��pH���ﵽ����������ӵ�Ŀ�ġ��������ܽ��������������ڲ�ͬpH�µ��ܽ������s/mol��L-1������Ҫ��ȥCuCl2��Һ������Fe3+��Ӧ������Һ��pHΪ ������ţ���

A����l B��4���� C������6 D������9
��4��ij��ҵ��ˮ�к���Cu2+��Pb2+��Hg2+������ҵ��ˮ�м��������FeS����FeS��CuS��PbS��HgS����ʱ����Һ��c��Fe2+����c��Pb2+����c��Hg2+��= �� �� ��
��֪��Ksp��FeS��=6.3��10-18mol2��L-2��Ksp��PbS��=3.4��10-28mol2��L-2
Ksp��CuS��=1.3��10-36mol2��L-2��Ksp��HgS��=6.4��10-53mol2��L-2
��5������������ԭ��Ӧ��Cu2+��aq��+Fe��s��===Fe2+��aq��+Cu��s����Ƴ���ͼ��ʾ��ԭ��أ�����ڸõ��װ�õ�˵���в���ȷ���� ������ţ���

A���缫X�IJ�����Fe
B���������ҺY��AgNO3��Һ
C��ԭ��ع���ʱ�������е������Ӳ���������ص��Ȼ�����Һ��
D��ԭ��ع���ʱ��x�缫��ӦΪ��O2+2H2O+4e-��4OH-
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com