
某溶液中可能含有H+、NH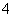 、Mg2+、Fe3+、Al3+、
、Mg2+、Fe3+、Al3+、
SO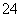 、HCO
、HCO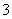 等离子中的一种或几种。当向该溶液中加入一定物质的量的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如下图所示。
等离子中的一种或几种。当向该溶液中加入一定物质的量的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如下图所示。
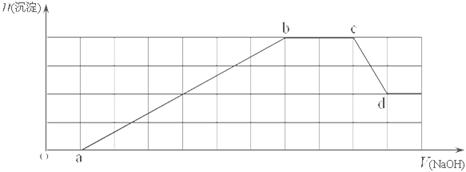
(1)原溶液中一定含有 ,一定不含有 ;
(2)cd段发生的离子反应为 ;
(3)原溶液中物质的量浓度最大的阳离子与原溶液中的阴离子的物质的量之比为 。
【知识点】离子反应
【答案解析】(1)H+、NH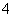 、Fe3+、Al3+、SO
、Fe3+、Al3+、SO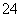 ; Mg2+、HCO
; Mg2+、HCO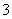
(2)Al(OH)3+4OH—=AlO2—+2H2O
(3)4:9
解析:在该溶液中加入NaOH溶液时没有产生沉淀,所以oa段发生的是H+与OH—的反应,即溶液中含有H+,同时没有HCO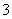 ;ab段产生沉淀,bc段沉淀不变,说明发生的是NH
;ab段产生沉淀,bc段沉淀不变,说明发生的是NH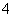 与OH—的反应,cd段沉淀溶解发生的只能是Al(OH)3和OH—的反应,说明溶液中含有Al3+;根据图像中沉淀的物质的量可以得到氢氧化铝的物质的量与另外一种沉淀的物质的量相等,而且形成这种沉淀消耗的碱液的体积与氢氧化铝的形成消耗的碱液的体积相等,故原溶液中剩余的离子中只能含有Fe3+而没有Mg2+。
与OH—的反应,cd段沉淀溶解发生的只能是Al(OH)3和OH—的反应,说明溶液中含有Al3+;根据图像中沉淀的物质的量可以得到氢氧化铝的物质的量与另外一种沉淀的物质的量相等,而且形成这种沉淀消耗的碱液的体积与氢氧化铝的形成消耗的碱液的体积相等,故原溶液中剩余的离子中只能含有Fe3+而没有Mg2+。
由H+ ≈ OH— Fe3+ ≈ 3OH— Al3+ ≈ 3OH— NH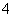 ≈ OH—
≈ OH—
1mol 1mol 1mol 3mol 1mol 3mol 1mol 1mol
和在图像中各离子消耗的氢氧化钠的体积可以得到H+、NH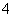 、Fe3+、Al3+的物质的量之比为1:2:1:1,根据在溶液中电荷守恒得到H+、NH
、Fe3+、Al3+的物质的量之比为1:2:1:1,根据在溶液中电荷守恒得到H+、NH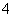 、Fe3+、Al3+、SO
、Fe3+、Al3+、SO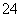 的的物质的量之比为1:2:1:1:4.5,物质的量最大的是NH
的的物质的量之比为1:2:1:1:4.5,物质的量最大的是NH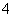 ,其与SO
,其与SO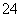 的物质的量之比为2:4.5即4:9。
的物质的量之比为2:4.5即4:9。
【思路点拨】正确的利用图像中体现的信息是非常重要的,在多种离子同时存在的溶液中,反应的先后顺序是解答此题的关键。此题难度较大,综合性较强。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是( )
A.反应产物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)====2HCl(g)在光照和点燃条件下的ΔH不同
查看答案和解析>>
科目:高中化学 来源: 题型:
由一种阳离子与两种酸根离子组成的盐
称为混盐。混盐CaOCl2在酸性溶液中可以发生反应产生Cl2,下列关于混盐CaOCl2的有关判断不正确的是(NA为阿伏加德罗常数)
A.该混盐在酸性溶液中产生1mol Cl2时转移的电子数为NA
B.该混盐的水溶液具有漂白性
C.该混盐中氯元素的化合价为+1和-1价
D.该混盐具有较强的还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
Fe2O3、ZnO、CuO的固体混合粉末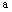 克,在加热条件下用足量CO还原,得到金属混合物2.41克,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00克白色沉淀,则a的数值为 ( )
克,在加热条件下用足量CO还原,得到金属混合物2.41克,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00克白色沉淀,则a的数值为 ( )
A.7.41B.3.59C.3.21D.2.46
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.等物质的量的Ba(OH)2与明矾[KAl(SO4)2·12H2O]加入足量水中:
3Ba2++6OH-+2Al3++3SO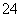 ===3BaSO4↓+2Al(OH)3↓
===3BaSO4↓+2Al(OH)3↓
B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O
C.H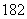 O中投入Na2O2固体:2H
O中投入Na2O2固体:2H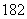 O+2Na2O2===4OH-+4Na++18O2↑
O+2Na2O2===4OH-+4Na++18O2↑
D.CuCl2溶液中加入H2S溶液:Cu2++S2-===CuS↓
查看答案和解析>>
科目:高中化学 来源: 题型:
在下图所示的物质转化关系中(反应条件和部分生成物未全部列出),X物质可以来自于海洋中,A、B为常见气体单质,B为黄绿色气体,I、L为常见的金属单质,G为红褐色物质。请回答下列问题:

(1)X化学式为 。 (2)C化学式为 。
(3)反应①的离子方程式为 。
(4)反应②的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在浓盐酸中H3AsO3与SnCl2的离子方程式为:3SnCl2+12Cl-+6 H++2H3AsO3=== 2As +3SnCl62-+6M,关于该反应的说法中正确的组合是
①氧化剂是H3AsO3 ②还原性:Cl->As ③ 每生成1mol As,反应中转移电子的物质的量为3 mol ④ M为OH- ⑤ SnCl62-是氧化产物
A.①③⑤ B.①②④⑤ C.①②③④ D.只有①③
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下在密闭容器中能表示可逆反应2SO2+O22SO3一定达到平衡状态的是( )
①消耗2 mol SO2的同时生成2 mol SO3
②SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中SO3的浓度不再改变
A.①② B.②③
C.只有③ D.只有①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com