
分析 利用极限法解答,假设混合物全是CuS,或混合物全是Cu2S,根据n=$\frac{m}{M}$计算n(CuO),根据电子转移守恒计算n(CuS)、n(Cu2S),再根据电子转移数目守恒,计算n(NO)、n(NO2),根据V=nVm计算气体体积,实际气体介于二者之间.
解答 解:若混合物全是CuS,其物质的量n(CuS)=n(CuO)=$\frac{12g}{80g/mol}$=0.15mol,转移电子物质的量=0.15×(6+2)=1.2mol.NO和NO2的体积相等,设NO的物质的量为x、NO2的物质的量为x,则3x+x=1.2,解得x=0.3,故气体体积V=0.6mol×22.4L/mol=13.44L;
若混合物全是Cu2S,其物质的量n(Cu2S)=$\frac{1}{2}$n(CuO)=$\frac{1}{2}$×0.15mol=0.075mol,转移电子物质的量0.075×10=0.75mol,设NO为xmol、NO2为xmol,3x+x=0.75,计算得x=0.1875,气体体积0.1875mol×2×22.4L/mol=8.4L,
故8.4L<V<13.44L,
答:气体体积范围为8.4L<V<13.44L.
点评 本题考查混合物计算、氧化还原反应计算,难度中等,注意守恒思想与极限法的利用,是对学生综合能力的考查


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O2和18O3互为同位素 | |
| B. | O2和O3的相互转化是物理变化 | |
| C. | 等物质的量的O2和O3含有相同的质子数 | |
| D. | 等质量的O2和O3含有相同的O原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 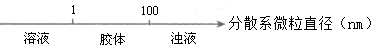 分散系的分类 | |
| B. | 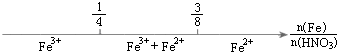 铁与稀硝酸反应后溶液中铁元素的存在形式 | |
| C. | 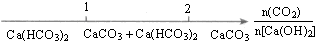 CO2通入澄清石灰水中反应的产物 | |
| D. | 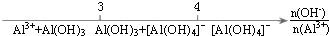 AlCl3溶液中滴加NaOH溶液后Al元素的存在形式 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
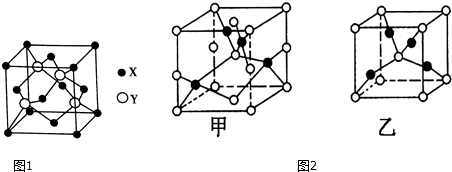
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 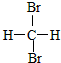 和 和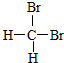 互为同分异构体 互为同分异构体 | |
| B. | 碳链为 与 与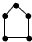 的烃为同系物 的烃为同系物 | |
| C. | 金刚石、石墨和“足球烯”C60为同素异形体 | |
| D. | H2和D2互为同位素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com