
| A. | Na2O2与足量CO2反应,共生成0.2mol O2,转移电子的数目为0.4NA | |
| B. | 室温下,1L pH=12的Ba(OH)2溶液中,由水电离的OH-离子数目为0.01NA | |
| C. | 0.1 mol聚丙烯中含有双键的数目为0.1NA | |
| D. | 含1mol FeCl3的饱和溶液最多可形成胶体粒子数为NA |
分析 A.过氧化钠和二氧化碳的反应是-1价氧元素变化为0价和-2价,生成1molO2电子转移2mol;
B.pH=12的氢氧化钡溶液中,氢氧根的浓度为0.01mol/L;
C.聚丙烯是丙烯加聚反应生成,聚丙烯中无双键;
D.一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
解答 解:A.Na2O2与H2O的反应是歧化反应:2Na2O2+2H2O=4NaOH+O2↑此反应转移2mol电子,生成1molO2,故当生成0.2molO2,转移电子0.4mol,数目为0.4NA,故A正确;
B.pH=12的氢氧化钡溶液中,氢氧根的浓度为0.01mol/L,氢离子浓度=10-12mol/L,故1L溶液中含有的氢氧根的物质的量为0.01mol,水电离出氢氧根离子水个数为10-12NA个,故B错误;
C.聚丙烯中无双键,故C错误;
D.一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故1mol氯化铁溶液形成的胶粒个数小于NA个,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,注意胶粒是粒子的集合体、聚丙烯是加成聚合产物,题目难度不大.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:选择题
| A. | 与Al产生H2的溶液中:Cl-、Na+、NO3- | |
| B. | 在某酸性透明的溶液中:Fe2+、H+、I- | |
| C. | 滴加KCSN试剂呈红色的溶液中:K+、SO32-、HCO3- | |
| D. | 在由水电离出的c(H+)×c(OH-)=1×10-24的溶液中:SO42-、F-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇、乙醇、氨气等都是重要的化工原料.
甲醇、乙醇、氨气等都是重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 屠呦呦女士用乙醚从黄花蒿中提取出青蒿素,该技术应用了萃取原理 | |
| B. | 油脂、淀粉、蛋白质等高分子化合物都属于混合物,一定条件下均可发生水解 | |
| C. | 离子交换膜在工业上应用广泛,如氯碱工业使用阳离子交换膜 | |
| D. | 用氨水法处理燃煤烟气中的二氧化硫,既可以除其污染,又可得到副产品硫酸铵 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的O2和O3在相同条件下所占的体积相同 | |
| B. | 电解精炼铜时,若转移6.02×1023个电子,则阳极溶解32g铜 | |
| C. | 1molCl2溶于足量水中,转移的电子数为NA | |
| D. | 2L 0.2mol•L-1硝酸与适量铁恰好完全反应(还原产物为NO),生成NO的分子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
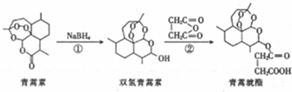
| A. | 青蒿素遇湿润的淀粉碘化钾试纸立刻变成紫色,是因为分子结构中含有过氧键 | |
| B. | 反应①属于还原反应,反应②的原子利用率为100% | |
| C. | 双氢青蒿素的苯溶液能与金属钠反应放出氢气 | |
| D. | 青蒿素和青蒿琥酯均能与碳酸氢钠溶液反应生成二氧化碳气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
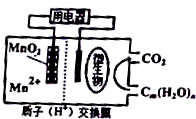
| A. | 在高温下使用更利于微生物发挥作用 | |
| B. | 每生成1molCO2转移4mole- | |
| C. | 放电过程中,质子通过交换膜从左侧移到右侧 | |
| D. | 负极反应式为:Mn2++2H2O-2e-=MnO2+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
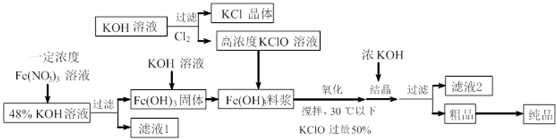
| A. | 控制反应温度30℃以下的原因是防止生成的K2FeO4发生分解 | |
| B. | 结晶过程中加入浓KOH溶液其作用是增大K+浓度,促进K2FeO4晶体析出 | |
| C. | 滤液2中阳离子可通过焰色反应检验确定 | |
| D. | 湿法制备高铁酸钾,也可以在Fe(OH)3料浆中直接通入足量氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 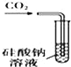 装置:可用来证明碳酸的酸性比硅酸强 | |
| B. | 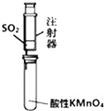 装置:可用来检验二氧化硫气体 | |
| C. | 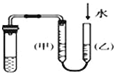 装置:用图示的方法不能检查此装置的气密性 | |
| D. | 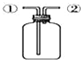 装置:先从①口进气集满二氧化碳,再从②口进气,可收集氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com