
在830K时,下列反应的平衡体系具有某些特殊性:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
①若起始浓度分别为c(CO)=3 mol·L-1,c(H2O)=0.75mol·L-1,达到平衡后CO的转化率为20%
②若起始浓度分别为c(CO)=3 mol·L-1,c(H2O)=4.5mol·L-1,达到平衡后CO的转化率为60%
设830K时,以起始浓度分别以c(CO)=a mol·L-1,c(H2O)=b mol·L-1投料,发生以上反应,测得平衡后c(H2)=c mol·L-1.
请注意上述数据,总结出其中规律,填写以下空白。
(1)选择填空:在多次试验中,若保持b不变而减小a,则达到平衡时CO的转化率________ 水蒸气的转化率________.
A.增大 B.减小 C.不变 D.无法确定
(2)当a=4,c=1.5时,b=______________.
(3)当a=2b时,a∶c=______________.
(4)a、b、c在该平衡中的关系式是__________________.
(1)A;B (2)2.4 (3)3∶1 (4)c/a +c/b=1
【解析】
试题分析:(1)设总体积为1L,在830K时,可逆反应CO(g)+H2O(g) CO2(g)+H2(g),当α(CO)=20%时,即有3mol?L-1×1L×20%=0.6molCO参加了反应,则一定有0.6molH2O同时参加反应,因此水蒸气的转化率是
CO2(g)+H2(g),当α(CO)=20%时,即有3mol?L-1×1L×20%=0.6molCO参加了反应,则一定有0.6molH2O同时参加反应,因此水蒸气的转化率是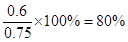 ;当α(CO)=60%时,则有3mol?L-1×1L×60%=1.8molCO参加了反应,则一定有1.8molH2O同时参加反应,则水蒸气的转化率为
;当α(CO)=60%时,则有3mol?L-1×1L×60%=1.8molCO参加了反应,则一定有1.8molH2O同时参加反应,则水蒸气的转化率为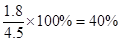 。从中可以看出,CO的转化率和水蒸气的转化率之和总是满足1,即增加c(H2O)时,α(CO)升高(20%→60%,升高了40%),而α(H2O)降低(80%→40%,降低了40%),并且符合20%+80%=100%,60%+40%=100%。由此可得出此题中的“某些规律”:①增大一种反应物的浓度,则该物质的转化率降低,而使另一种反应物的转化率升高,且升高率与该物质的转化率降低率相等。所以当b不变、a减小时,α(CO)增大,α(H2O)减小。
。从中可以看出,CO的转化率和水蒸气的转化率之和总是满足1,即增加c(H2O)时,α(CO)升高(20%→60%,升高了40%),而α(H2O)降低(80%→40%,降低了40%),并且符合20%+80%=100%,60%+40%=100%。由此可得出此题中的“某些规律”:①增大一种反应物的浓度,则该物质的转化率降低,而使另一种反应物的转化率升高,且升高率与该物质的转化率降低率相等。所以当b不变、a减小时,α(CO)增大,α(H2O)减小。
②各反应物的转化率之和总为100%。若用代数式表示则为: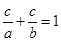 。
。
(2)将a=4,c=1.5代入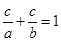 ,即得到b=2.4
,即得到b=2.4
(3)当a=2b时,根据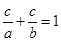 可知,a∶c=3∶1
可知,a∶c=3∶1
考点:考查可逆反应的有关计算
点评:本题属于难度较大的化学平衡的计算题,对学生的思维能力提出了更高的要求。该题有利于培养学生严谨的逻辑思维能力,以及灵活运用知识解决实际问题的能力,有利于激发学生的求知欲,提高学习兴趣和学习积极性。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:阅读理解
燃煤废气、汽车尾气中的氮氧化物(NOx)、一氧化碳等有害气体,常用下列方法处理,以减少对环境的污染。
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ·mol-1
则1molCH4将NO2还原为N2的反应热为 ;
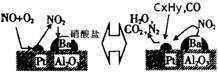
(2)除氮氧化物及CO外,汽车尾气中还含有碳氢化合物等污染物,下图是汽车尾气转化研究的示意图:表示的是Pt/Al2O3/Ba表面吸附与解吸作用的机理,氮氧化物是NO2,碳氢化合物是CxHy,写出两者反应的化学方程式: ,Pt/Al2O3/Ba的作用是 ;
(3)平衡常数K的数值大小,是衡量化学反应进行程度的标志,K的数值越大,化学反应的限度越大,反应物反应的越充分。在25℃时,下列反应的平衡常数如下:
N2(g)+O2(g) 2NO(g) K1=1×10-30 ㈠
2H2(g)+O2(g) 2H2O(g) K2=2×1081 ㈡
2CO2 (g) 2CO(g)+O2(g) K3=4×10-92 ㈢
![]() ①常温下,反应2H2O(g) 2H2(g) +O2(g) 平衡常数K= ;
①常温下,反应2H2O(g) 2H2(g) +O2(g) 平衡常数K= ;
②关于以上反应,下列说法正确的是
A.常温下,NO,H2O,CO2三种化合物分解放出氧气的倾向大小顺序:NO>H2O>CO2
B.若升高温度,反应㈢的平衡常数K3将增大
C.若只增加压强,且反应物、生成物状态不变,反应㈠平衡不发生移动,平衡常数不变;反应㈡平衡朝正向移动,平衡常数增大
D.若增加汽车发动机空气的进气量,可同时减少氮氧化物和一氧化碳的排放
③基于环保法规,要求改装汽车尾气处理装置,达到使氮氧化物(NO)、一氧化碳转化为无污染、可排放的气体的目的。改装的方法主要是加入有效催化剂,请你根据以上有关数据分析,在不改变其它条件的情况下,可使用催化剂除污染气体的原因: 。
查看答案和解析>>
科目:高中化学 来源:2012届浙江省台州市高三上学期期末质量评估化学试卷 题型:填空题
燃煤废气、汽车尾气中的氮氧化物(NOx)、一氧化碳等有害气体,常用下列方法处理,以减少对环境的污染。
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
则1molCH4将NO2还原为N2的反应热为 ;
(2)除氮氧化物及CO外,汽车尾气中 还含有碳氢化合物等污染物,下图是汽车尾气转化研究的示意图:表示的是Pt/Al2O3/Ba表面吸附与解吸作用的机理,氮氧
还含有碳氢化合物等污染物,下图是汽车尾气转化研究的示意图:表示的是Pt/Al2O3/Ba表面吸附与解吸作用的机理,氮氧 化物是NO2,碳氢化合物是CxHy
化物是NO2,碳氢化合物是CxHy ,写出两者反应的化学方程式: ,Pt/Al2O3/Ba的作用是 ;
,写出两者反应的化学方程式: ,Pt/Al2O3/Ba的作用是 ;
(3)平衡常数K的数值大小,是衡量化学反应进行程度的标志,K的数值越大,化学反应的限度越大,反应物反应的越充分。在25℃时,下列反应的平衡常数如下:
N2(g)+O2(g) 2NO(g) K1=1×10-30 ㈠
2NO(g) K1=1×10-30 ㈠
2H2(g)+O2(g) 2H2O(g) K2=2×1081 ㈡
2H2O(g) K2=2×1081 ㈡
2CO2 (g) 2CO(g)+O2(g) K3=4×10-92 ㈢
2CO(g)+O2(g) K3=4×10-92 ㈢ ①常温下,反应2H2O(g) 2H2(g)
①常温下,反应2H2O(g) 2H2(g) +O2(g) 平衡常数K= ;
+O2(g) 平衡常数K= ;
②关于以上反应,下列说法正确的是
A. 常温下,NO,H2O,CO2三种化合物分解放出氧气的倾向大小顺序:NO>H2O>CO2 常温下,NO,H2O,CO2三种化合物分解放出氧气的倾向大小顺序:NO>H2O>CO2 |
| B.若升高温度,反应㈢的平衡常数K3将增大 |
| C.若只增加压强,且反应物、生成物状态不变,反应㈠平衡不发生移动,平衡常数不变;反应㈡平衡朝正向移动,平衡常数增大 |
| D.若增加汽车发动机空气的进气量,可同时减少氮氧化物和一氧化碳的排放 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省台州市高三上学期期末质量评估化学试卷 题型:填空题
燃煤废气、汽车尾气中的氮氧化物(NOx)、一氧化碳等有害气体,常用下列方法处理,以减少对环境的污染。
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ·mol-1
则1molCH4将NO2还原为N2的反应热为 ;
(2)除氮氧化物及CO外,汽车尾气中还含有碳氢化合物等污染物,下图是汽车尾气转化研究的示意图:表示的是Pt/Al2O3/Ba表面吸附与解吸作用的机理,氮氧化物是NO2,碳氢化合物是CxHy,写出两者反应的化学方程式: ,Pt/Al2O3/Ba的作用是 ;
(3)平衡常数K的数值大小,是衡量化学反应进行程度的标志,K的数值越大,化学反应的限度越大,反应物反应的越充分。在25℃时,下列反应的平衡常数如下:
N2(g)+O2(g)  2NO(g) K1=1×10-30 ㈠
2NO(g) K1=1×10-30 ㈠
2H2(g)+O2(g)  2H2O(g)
K2=2×1081 ㈡
2H2O(g)
K2=2×1081 ㈡
2CO2 (g) 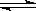 2CO(g)+O2(g) K3=4×10-92 ㈢
2CO(g)+O2(g) K3=4×10-92 ㈢
 ①常温下,反应2H2O(g)
2H2(g) +O2(g) 平衡常数K= ;
①常温下,反应2H2O(g)
2H2(g) +O2(g) 平衡常数K= ;
②关于以上反应,下列说法正确的是
A.常温下,NO,H2O,CO2三种化合物分解放出氧气的倾向大小顺序:NO>H2O>CO2
B.若升高温度,反应㈢的平衡常数K3将增大
C.若只增加压强,且反应物、生成物状态不变,反应㈠平衡不发生移动,平衡常数不变;反应㈡平衡朝正向移动,平衡常数增大
D.若增加汽车发动机空气的进气量,可同时减少氮氧化物和一氧化碳的排放
③基于环保法规,要求改装汽车尾气处理装置,达到使氮氧化物(NO)、一氧化碳转化为无污染、可排放的气体的目的。改装的方法主要是加入有效催化剂,请你根据以上有关数据分析,在不改变其它条件的情况下,可使用催化剂除污染气体的原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
平衡常数KC的数值大小,是衡量化学反应进行程度的标志。在25℃时,下列反应的平衡常数如下:
N2(g) + O2(g) ![]() 2NO(g) K1 = 1×10-30
2NO(g) K1 = 1×10-30
2H2(g) + O2(g) ![]() 2H2O(g) K2 = 2×10 81
2H2O(g) K2 = 2×10 81
2CO2 (g) ![]() 2CO(g)+O2(g) K3 = 4×10-92
2CO(g)+O2(g) K3 = 4×10-92
(1)常温下,NO分解产生O2反应的平衡常数的表达式为K = 。
(2)常温下,水分解产生O2,此时平衡常数值约为K = 。
(3)常温下,NO,H2O,CO2 三种化合物分解放出氧气的倾向大小顺序为 。
(4)北京市政府要求全市对所有尾气处理装置完成改装,以求基本上除去氮氧化物、一氧化碳污染气体的排放,而改装后的尾气处理装置主要是加入有效催化剂,你根据以上有关数据分析,仅使用催化剂除污染气体的可能性。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com