
����Ŀ����ͬ��ͬѹ�£����и����Ȼ�ѧ����ʽ�У���H2����H1���ǣ� ��
A.H2 ��g��+Cl2��g���T2HCl��g������H1 ![]() H2��g��+
H2��g��+ ![]() Cl2��g���THCl��g������H2
Cl2��g���THCl��g������H2
B.2H2��g��+O2 ��g���T2H2O��g������H1 2H2 ��g��+O2 ��g���T2H2O��l������H2
C.CO��g��+ ![]() O2��g���TCO2��g������H1 2CO��g��+O2��g���T2CO2��g������H2
O2��g���TCO2��g������H1 2CO��g��+O2��g���T2CO2��g������H2
D.S��s��+O2��g���TSO2 ��g������H1 S��g��+O2��g���TSO2 ��g������H2
���𰸡�A
���������⣺A����ѧ��Ӧ����ʽ��ϵ���ӱ����ʱ���ֵ�ӱ����û��Ϸ�Ӧ�Ƿ��ȵģ������ʱ�ֵ�Ǹ�ֵ��2��H2=��H1 �� �ʡ�H1����H2 �� ����ȷ��
B�����ʵ�ȼ�շ�Ӧ�Ƿ��ȵģ������ʱ��Ǹ�ֵ��Һ̬ˮ��Ϊ��̬ˮ�Ĺ��������ȵģ��ʡ�H1����H2 �� �ʴ���
C����ѧ��Ӧ����ʽ��ϵ���ӱ����ʱ���ֵ�ӱ����û��Ϸ�Ӧ�Ƿ��ȵģ������ʱ�ֵ�Ǹ�ֵ��2��H1=��H2 �� ��H1����H2 �� �ʴ���
D�����ʵ�ȼ�շ�Ӧ�Ƿ��ȵģ������ʱ��Ǹ�ֵ���������Ϊ��̬����Ҫ����������������ȼ�շ��ȶ࣬���ԡ�H1����H2 �� �ʴ���
��ѡA��
A��Һ̬ˮ��Ϊ��̬ˮ�Ĺ��������ȹ��̣�
B���������Ϊ��̬����Ҫ����������
C��̼������ȫȼ�շ��ȶ��ڲ���ȫȼ�շŵ��ȣ�
D����ѧ��Ӧ����ʽ��ϵ���ӱ����ʱ���ֵ�ӱ�


 �������ͬ������ϵ�д�
�������ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. ͬ��ͬѹ�£���ͬ��������ʣ������ʵ���һ�����
B. �κ��������������ʵ�����CH4��C0�����ķ�����һ�����
C. 1LCO����һ����1LO2������С
D. ��״���£�2.24LCCl4��6.02��1022������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ�������
A.��KClO3���KCl������뻹ԭ��
B.�������Һ�м�����������������Һ�������кͷ�Ӧ����Һ�ĵ�����������
C.��֪��ˮ���ܶȱ�ˮС����Ũ��Խ���ܶ�ԽС�������������ֱ�Ϊ5%��15%�İ�ˮ�������ϣ��õ�����Һ��������������10%
D.һ�������£�H2��O2�Ļ������Ե���������ܶ�Ϊ1����H2��O2�����ʵ���֮��Ϊ2��13
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������ѧϰ��ѧ����Ҫ���ߣ�����������ʾ���ʱ仯�Ļ�ѧ�����У���ȷ���ǣ� ��
A.����ȼ�ϵ�������Խ����е�������Ӧʽ��O2+4H++4e���T2H2O
B.��������������̼����������ⱥ���Ȼ�����Һ�����ӷ���ʽΪ��2C1��+2H2O ![]() H2��+Cl2��+2OH��
H2��+Cl2��+2OH��
C.��ͭ����ʱ�����Դ�����������Ǵ�ͭ���缫��ӦʽΪ��Cuһ2e��=Cu2+
D.��ӦHCl��aq��+NaOH��aq���TNaCl��aq��+H2O��l����H��0�������������������ԭ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵķ����м��ЦҼ������Цм����ǣ� ��
��HCl ��H2O ��N2 ��H2O2 ��C2H4 ��C2H2 ��
A.�٢ڢ�
B.�ۢܢݢ�
C.�٢ۢ�
D.�ۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС������ͼװ�õ��CuSO4��Һ���ⶨͭ�����ԭ�������� 
��1����ʵ���вⶨ�ڱ�״���·ų������������VL��B����ֱ����Դ�����������������������д��B��������Ӧ�ĵ缫��Ӧʽ ��
��2����ʼһ��ʱ�����U�ι��пɹ۲쵽������ ��
��д���õ�ⷴӦ�ܵ����ӷ���ʽ ��
��3��ʵ���л���ⶨ������������д��ţ���
��A������������mg ��B������������mg
��4��ͭ�����ԭ������Ϊ�����ú���m��V�ļ���ʽ��ʾ����
��5������ü��ԣ�KOHΪ����ʣ�����ȼ�ϵ����Ϊ��Դ����ʵ�飬�ŵ�ʱ�����ĵ缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50mL 0.50molL��1������50mL 0.55molL��1 NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ���ⶨǿ����ǿ�Ӧ�ķ�Ӧ�ȣ� 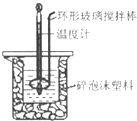
��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | �¶Ȳ� | |||
HCl | NaOH | ƽ��ֵ | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
��1���ڸ�ʵ���У���ȡ50mL�����NaOH��Һ����Ҫ�õ��IJ���������
��2��װ���д�С�ձ�֮����������ĭ���ϵ�Ŀ������
��3��ijͬѧʵ���¼���������ϱ���ʾ�����м�¼����ֹ�¶���ָ�¶ȣ�
��4�������ʵ�鷢���кͷ�Ӧʱ�ų�������ΪkJ[�кͺ����ɵ���Һ�ı�����c=4.18J��g�棩��1 �� ϡ��Һ���ܶȶ�Ϊ1gcm��3]��
��5�������50mL 0.55mol/L�İ�ˮ��NH3H2O������NaOH��Һ��������ʵ�飬ͨ����õķ�Ӧ�ȼ����к��ȣ����к��ȡ�H��ƫ����ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ����˵������ȷ���ǣ� ��
A.���ɵ��ʷ��ӵ�����һ�����й��ۼ�
B.�ɷǽ���Ԫ����ɵĻ����ﲻһ���ǹ��ۻ�����
C.�Ǽ��Լ�ֻ������˫ԭ�ӵ��ʷ�����
D.��ͬԪ����ɵĶ�ԭ�ӷ�����Ļ�ѧ��һ���Ǽ��Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��1���⻯�ƣ�NaH��Ϊ��ɫ���壬����H���к�ǿ�Ļ�ԭ�ԣ���˳����⻯���ڸ����½�TiCl4��ԭΪTi������������Ϊ+1�ۣ�д���仯ѧ��Ӧ����ʽ�����õ����ű������ת�Ƶķ�������Ŀ��NaH����ˮ���ҷ�ӦNaH +H2O=NaOH+H2����NaH��Һ��Ҳ�����Ʒ�Ӧ��д����Ӧ�Ļ�ѧ����ʽ��
��2����ƽ��Ӧ����ʽ����![]() Al��
Al�� ![]() NaNO3��
NaNO3�� ![]() H2O=
H2O= ![]() Al(OH)3��
Al(OH)3�� ![]() N2����
N2���� ![]() NaAlO2
NaAlO2
��3��ʵ������MnO2��Ũ�����������ķ�ӦΪMnO2��4HCl(Ũ) ![]() MnCl2��2H2O��Cl2������Ӧ�У������17.4 g��MnO2����ԭ����ô��
MnCl2��2H2O��Cl2������Ӧ�У������17.4 g��MnO2����ԭ����ô��
�ٱ��������Ȼ��������Ϊ��
��ת�Ƶ��ӵ���ĿΪ��
�۷�֯��ҵ�г���������Ư����Ư�ײ�ƥ����������Ҫ��ȥ��ͨ������Na2SO3�������ȼ��������Ⱥ�IJ���ΪNa2SO4 �� �ȱ�Ϊ��1�ۡ����ѱ����в�����Cl2��ȫת������ҪNa2SO3������Ϊ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com