
| A. | CaO | B. | CO2 | C. | K2O | D. | Ca(OH )2 |
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=1 | |
| B. | B的转化率为20% | |
| C. | 平衡时A的浓度为1.50mol/L | |
| D. | 达到平衡时,在相同温度下容器内混合气体的压强与反应前相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
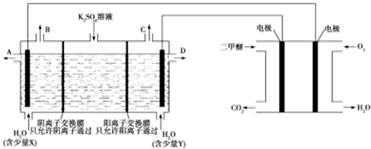
| A. | Y为KOH | |
| B. | A口导出的物质为H2SO4 | |
| C. | 二甲醚燃料电池的负极反应式为CH3OCH3+3H2O-12e-═2CO2+12H+ | |
| D. | 若燃料电池通入CH3OCH3(g)的速率为0.1mol/min,2min时,理论上C口收集到气体的体积为26.88L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | l molH2O (I)变成lmolH2O (g),向外界释放能量 | |
| B. | 1molH2O (g)分解成H2(g)和O2(g),吸收241. 8kJ能量 | |
| C. | 2mol H2(g)和l mol O2(g)的总能量小于2molH2O(1)的能量 | |
| D. | 断裂2molH2O (g)中所有的O-H键,吸收483.6 kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
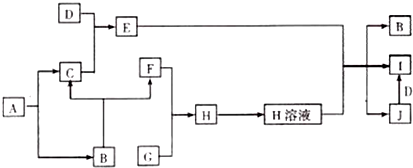
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶于酸的物质 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
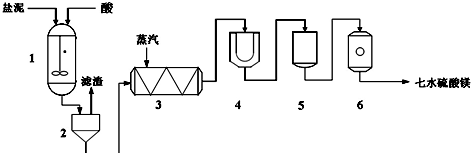
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
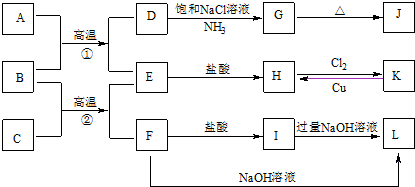
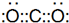 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2+2Br-=Br2+2Cl- | |
| B. | 4Cl2+6Br-+2Fe2+=2Fe3++3Br2+8Cl- | |
| C. | 3Cl2+2Fe2++4Br-=2Fe3++2Br2+6Cl- | |
| D. | 2Cl2+2Fe2++2Br-=2Fe3++Br2+4Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com