
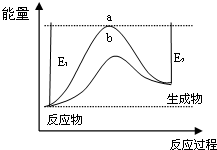
 已知CO和H2在一定条件下合成甲醇的反应为CO(g)+2H2(g)?CH3OH(g),现在容积固定且相等的a、b、c三个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度进行反应,测得相关数据的关系如图所示.下列说法正确的是( )
已知CO和H2在一定条件下合成甲醇的反应为CO(g)+2H2(g)?CH3OH(g),现在容积固定且相等的a、b、c三个密闭容器中分别充入1molCO和2molH2的混合气体,控制温度进行反应,测得相关数据的关系如图所示.下列说法正确的是( )| A. | a容器中,0~5min反应速率v(H2)=0.08mol•L-1•min-1 | |
| B. | 反应进行到5min时,b容器中v正=v速 | |
| C. | 其他条件不变时,减压可将b中的状态转变成c中的状态 | |
| D. | 达到平衡时a、b、c容器中的转化率为b>a>c |
分析 A、根据图象可以看出,5min时甲醇的物质的量浓度为0.4mol/L,依据反应速率△V=$\frac{△c}{△t}$计算甲醇反应速率,速率之比等于化学方程式计量数之比计算得到氢气的反应速率;
B、根据图2,分析反应进行到5min时,a容器是否达到平衡状态来判断正逆反应速率的关系,反应进行到5min时,如达到平衡,升高温度甲醇的体积分数应减小,但图象中给出的是增大,说明还没有达到平衡状态;
C、b中的平衡状态转变成c中的平衡状态,甲醇的体积分数减小,说明平衡逆向移动,根据方程式的特点,升高温度或减压都可以;
D、根据温度对平衡的影响来判断,升高温度平衡逆向移动,CO的转化率减小.
解答 解:A、5min时甲醇的物质的量浓度为0.4mol/L,依据反应速率△V=$\frac{△c}{△t}$计算甲醇反应速率=$\frac{0.4mol/L}{5min}$=0.08mol/L•min,速率之比等于化学方程式计量数之比计算得到氢气的反应速率,v(H2)=2V(CH3OH)=2×0.08mol•L-1•min-1=0.16mol•L-1•min-1,故A错误;
B、从图2可以看出,反应进行到5min时,a容器的反应如达到平衡,升高温度,平衡向逆向移动,甲醇的体积分数应减小,但图象中给出的是增大,说明还没有达到平衡状态,v正≠v速,故B错误;
C、b中的平衡状态转变成c中的平衡状态,甲醇的体积分数减小,说明平衡逆向移动,因为反应是放热反应,升高温度,平衡向逆向移动;又知反应物的化学计量数之和大于生成物的,减小压强平衡逆向移动,减压可将b中的状态转变成c中的状态,故C正确;
D、达到平衡时,a、b、c三个容器的反应温度不同,a容器温度最低,c容器的反应温度最高,根据反应放热可判断出,升高温度,平衡逆向移动,甲醇的体积分数减小,故应为a>b>c,故D错误;
故选C.
点评 本题考查化学平衡图象题,做题时注意从图象中曲线的变化趋势分析条件改变导致平衡移动的特点,本题难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸是铅蓄电池的电解质溶液,铅蓄电池可实现化学能转变成电能 | |
| B. | 硅酸干凝胶是硅酸干燥剂的主要成分,作用是吸收水分 | |
| C. | 肥皂的主要成分是硬脂酸钠,可以用于除去油污 | |
| D. | 二氧化硅是光能转化为电能的转化材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
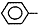 CH=CH2),聚苯乙烯的化学式为
CH=CH2),聚苯乙烯的化学式为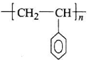 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 浓度/mol•L-1 时间 | c(NH3) | c(O2) | c(NO) |
| 0min | 1.000 | 1.600 | 0.000 |
| 2min | 0.600 | a | 0.400 |
| 4min | 0.500 | 0.975 | 0.500 |
| 6min | 0.500 | 0.975 | 0.500 |
| 8min | 0.700 | 1.225 | 0.750 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| t/s | 0 | 3 | 6 | 12 | 24 |
| n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
| A. | 反应在0~3s的平均速率为v(NO2)=0.24mol•L-1•s-1 | |
| B. | 24s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44mol•L-1,则反应的△H<0 | |
| C. | 在T温度下,起始时向容器中充入1.0molNO2、0.5molO3和0.50molN2O5、0.50molO2,反应达到平衡时,压强为起始的0.88倍 | |
| D. | 在T温度下,起始时向容器中充入2.0molN2O5和2.0molO2,达到平衡时,N2O5的转化率大于20% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第5周期第IA族 | B. | 第4周期第IA族 | C. | 第3周期第IA族 | D. | 第3周期第IA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气反应:CH4+4Cl2→CCl4+4HCl | |
| B. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 乙醇和钠反应:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | |
| D. | 苯和浓硝酸、浓硫酸的混合物水浴60℃反应: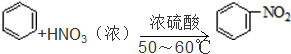 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4$\stackrel{高温}{→}$C+2H2 | |
| B. | CH3CH=CH2+Br2$\stackrel{CCl_{4}}{→}$CH3CHBrCH2Br | |
| C. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | |
| D. | C2H6+Cl2$\stackrel{光}{→}$C2H5Cl+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B2A3 | B. | B2A | C. | BA2 | D. | BA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com