
分析 根据BaCO3的溶解平衡:BaCO3?Ba2++CO32-,H+能与CO32-反应生成水和二氧化碳,促进溶解平衡正向移动;
II.(1)含有相同的离子能抑制硫酸钡的溶解,难溶物质向更难溶物质进行转化;
(2)根据硫酸钡的溶度积常数计算硫酸根离子和钡离子浓度;
(3)先计算混合溶液中氢氧根离子浓度,再根据离子积公式计算氢离子浓度,从而确定溶液的pH值.
解答 解:硫酸钡不溶于水和酸,但胃酸可与CO32-反应生成水和二氧化碳,使CO32-浓度降低,从而使平衡BaCO3(s)?Ba2+(aq)+CO32-(aq) 向溶解方向移动,使Ba2+浓度增大,且Ba2+有毒,所以不能用碳酸钡代替硫酸钡,反应离子方程式为:
BaCO3+2H+═Ba2++H2O+CO2↑,
故答案为:BaCO3+2H+═Ba2++H2O+CO2↑;
Ⅱ(1)根据难溶电解质的溶度积常数知,溶液中硫酸根离子浓度越大,硫酸钡的溶解度越小,钡离子浓度越低,氢氧化钡能抑制硫酸钡的电离,但氢氧化钡溶液中含有钡离子,所以钡离子浓度最大;水中的钡离子浓度次之;硫酸钠溶液和硫酸溶液中都含有硫酸根离子,抑制硫酸钡的电离,硫酸钠中的硫酸根浓度大于硫酸中的浓度,所以硫酸钠溶液中钡离子的浓度小于硫酸溶液中钡离子浓度,所以钡离子浓度大小顺序是:b>a>d>c,故选B;
(2)b中C(SO4 2-)=$\frac{1.1×1{0}^{-10}}{0.2}$=5.5×10-10mol/L,c中C(Ba2+)=$\frac{1.1×1{0}^{-10}}{0.5mol/L}$mol/L=2.2×10-10mol/L,
故答案为:5.5×10-10mol/L,2.2×10-10mol/L;
(3)40ml 0.2mol•L-1的Ba(OH)2溶液和40ml 0.1mol•L-1的H2SO4溶液中混合后溶液中C(OH-)=$\frac{(0.2-0.1)mol/L×2×0.04L}{0.04L×2}$=0.1mol/L,则C(H+)=10-13 mol/L,所以pH=13,故答案为:13.
点评 本题考查了溶液中各种离子浓度大小的比较、混合溶液pH值的计算、平衡常数的计算等知识点,难度较大,注意酸碱混合溶液中pH值的计算时溶液的体积为混合体积,否则会导致错误.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol羟基 ( 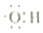 ) 中含有的电子数为0.7NA ) 中含有的电子数为0.7NA | |
| B. | 1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA | |
| C. | 由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COC-数目为NA | |
| D. | 14g乙烯与丙烯混合气体中的氢原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 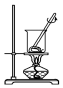 灼烧海带 | B. | 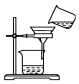 过滤得含I-的溶液 | ||
| C. | 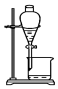 放出碘的苯溶液 | D. |  分离碘并回收苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量 Na2CO3 和 NaHCO3 分别和足量盐酸反应,相同条件下前者生成 CO2 少 | |
| B. | 将石灰水分别加入 NaHCO3 和 Na2CO3 中,前者不生成沉淀 | |
| C. | 相同条件下 Na2CO3 比 NaHCO3 更易溶于水 | |
| D. | Na2CO3 固体中含少量 NaHCO3,可用加热法除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)═0.1mol•L-1•min | B. | v(B)═0.2 mol•L-1•min | ||
| C. | v(C)═0.3 mol•L-1•min | D. | v(D)═0.4mol•L-1•min |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)=c(HCO3-)+c(H2CO3) | B. | 2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | ||
| C. | c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | D. | c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅与NaOH溶液反应:SiO2+2OH-═SiO32-+H2O | |
| B. | 碳酸钡溶于稀盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 氯气与NaOH溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 把水玻璃滴入盐酸中:SiO32-+2H+═H2SiO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸和碱反应只能生成盐和水 | |
| B. | ${\;}_{7}^{14}$N+${\;}_{0}^{1}$n→${\;}_{6}^{12}$C+${\;}_{1}^{3}$H,此过程为化学变化 | |
| C. | 金属主要发生吸氧腐蚀,其本质是被氧化 | |
| D. | Na2O2的水溶液能导电,所以Na2O2是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com