
 。以下实验取用不同质量的铵盐混合物均加入同浓度的50.00mL的NaOH溶液, 加热充分反应,将产生的气体A经干燥之后用浓硫酸吸收。
。以下实验取用不同质量的铵盐混合物均加入同浓度的50.00mL的NaOH溶液, 加热充分反应,将产生的气体A经干燥之后用浓硫酸吸收。 设氢氧化钠的物质的量浓度为Cmol/L,
设氢氧化钠的物质的量浓度为Cmol/L, 设10克中有Xmol的 (NH4)2SO4和ymol的NH4HSO4则
设10克中有Xmol的 (NH4)2SO4和ymol的NH4HSO4则 132X + 115y=10.(1)
132X + 115y=10.(1) 10g时说明铵盐不足,
10g时说明铵盐不足,  20g时铵盐已经过量,
20g时铵盐已经过量,  n(NH3)="2X" + y=50C×10—3—2y.(2)
n(NH3)="2X" + y=50C×10—3—2y.(2) 30g时铵盐过量,
30g时铵盐过量, 
 50C×10—3—3y=0.68/17.(3)
50C×10—3—3y=0.68/17.(3) 联立(1) (2) (3)解得
联立(1) (2) (3)解得 X=0.02mol y=0.064mol C=4.64mol/L
X=0.02mol y=0.064mol C=4.64mol/L 氮的质量分数="(0.04+0.064)" ×14/10×100%=14.56% )
氮的质量分数="(0.04+0.064)" ×14/10×100%=14.56% ) NH3↑+H2O,产生的气体A为氨气,化学式为NH3。
NH3↑+H2O,产生的气体A为氨气,化学式为NH3。

 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源:不详 题型:单选题
| A.在pH=13的溶液中:Na+、Ba2+、Cl-、NO3- |
| B.使石蕊试液变红的溶液:Na+、ClO-、Cl-、NO3- |
| C.无色溶液: Cu2+、K+、SO42-、Cl- |
| D.强碱性溶液:K+、Mg2+、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.饱和氯水中:Cl-、NO3-、Na+、CO32- |
| B.c(H+)=1.0×10-13 mol·L-1的溶液中:C6H5O-、K+、SO42-、Br- |
| C.酚酞呈红色的溶液中:SO42-、 K+、Cl-、HSO3- |
| D.pH=2的溶液中:NO3-、I-、Na+、Al3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=1的溶液中:K+、Fe2+、C1—、NO3— |
| B.加入Al能放出H2的溶液中:NH4+、SO42—、C1—、HCO3- |
| C.在含有大量Fe3+的溶液中:NH4+、C1—、Na+、SCN— |
| D.由水电离的c(OH—)=10-13mol·L—1的溶液中:Ba2+、Na+、C1—、 Br— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na+、Cu2+、Cl-、SO42- | B.K+、H+、SO42-、OH-、 |
| C.Na+、H+、Cl-、CO32- | D.Na+、Ca2+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题



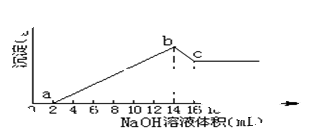
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42- |
| B.水电离出的c(H+)=1×10-13mol·L-1的溶液中:K+、HC03-、Cl-、S2- |
| C.使pH试纸显蓝色的溶液中:Cu2+、Fe3+、N03-、SO42- |
| D.在A1C13溶液中:Na+、[Al(OH)4]-、SO42-、N03- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaOH溶液 | B.蒸馏水 | C.Na2SO3溶液 | D.KI溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 |
| B.某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42- |
| C.某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 |
| D.验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com