
| 编号 | 电极材料 | 电解质溶液 | 电子流向 |
| ① | Mg—Al | HNO3(浓) | Mg→Al |
| ② | Mg—Al | HCl(aq) | Mg→Al |
| ③ | Mg—Al | NaOH(aq) | Al→Mg |
| ④ | Al—Cu | HNO3(浓) | Cu→Al |


科目:高中化学 来源:不详 题型:填空题
 溶液、
溶液、 溶液、盐酸。按要求回答下列问题:
溶液、盐酸。按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
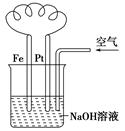
| A.这是电解NaOH溶液的装置 |
| B.溶液中发生了变化:4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| C.Fe为正极,电极反应为:Fe-2e-+2OH-=Fe(OH)2 |
| D.NaOH溶液的碱性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通人CH4的电极为负极 |
| B.正极发生氧化反应 |
| C.燃料电池工作时,溶液中的OH-向负极移动 |
| D.该电池使用一段时间后应补充KOH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.这是电解NaOH溶液的装置 |
| B.电子由Fe流向Pt |
| C.Pt为正极,其电极反应为:2H++2e-=H2↑ |
| D.Fe为负极,其电极反应为:4OH-4e-=2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com