下表是周期表中的一部分,请回答下列问题:

(1)A是④的最高价含氧酸,其化学式为
H2SO4
H2SO4
,A中所含的化学键类型为
共价键
共价键
.
(2)将③对应的单质投入A的稀溶液中,发生的反应属于
放热
放热
反应(填“吸热”或“放热”),该反应中反应物的总能量
大于
大于
生成物的总能量(填“大于”或“小于”);若将③对应的单质和铁用导线连接后投入A的稀溶液中,组成的装置中能量转化形式主要是
化学能转化为电能
化学能转化为电能
,该装置正极材料是
Fe
Fe
.
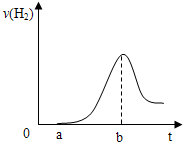
(3)把在空气中久置的③的单质投入A的稀溶液中,产生氢气的速率与反应时间的关系可用如图曲线表示:
曲线0→a段不产生氢气的原因是
铝表面被O2氧化为致密的氧化膜,限制了铝与H2SO4的反应
铝表面被O2氧化为致密的氧化膜,限制了铝与H2SO4的反应
,曲线a→b段产生氢气速率逐渐增大的主要原因是
反应放热,温度升高是影响反应速率的主要因素,使反应速率增大
反应放热,温度升高是影响反应速率的主要因素,使反应速率增大
,
曲线由b以后产生氢气速率逐渐减小的主要原因是
随反应c(H+)减小,该因素变为影响化学反应速率的主要因素,化学反应速率开始下降
随反应c(H+)减小,该因素变为影响化学反应速率的主要因素,化学反应速率开始下降
.
(4)①和②对应的单质在一个固定体积的密闭容器中发生可逆反应,该反应达到平衡的标志是
各成分的浓度(或质量、物质的量、压强等)不再变化
各成分的浓度(或质量、物质的量、压强等)不再变化
(请列举一项).




