
分析 将0.2mol/L HA溶液与0.2mol/L NaOH溶液等体积混合后,二者恰好反应生成NaA,溶液中存在c(Na+)>c(A-),根据电荷守恒得c(H+)<c(OH-),溶液呈碱性,则HA是弱酸;
(1)溶液呈碱性,说明A-发生水解而导致溶液呈碱性,但水解程度较小;
(2)二者混合时溶液体积增大一倍,浓度降为原来的一半,任何电解质溶液中都存在物料守恒,根据物料守恒计算;
(3)酸或碱抑制水电离,含有弱离子的盐促进水电离.
解答 解:将0.2mol/L HA溶液与0.2mol/L NaOH溶液等体积混合后,二者恰好反应生成NaA,溶液中存在c(Na+)>c(A-),根据电荷守恒得c(H+)<c(OH-),溶液呈碱性,则HA是弱酸;
(1)溶液呈碱性,说明A-发生水解而导致溶液呈碱性,但水解程度较小,所以混合溶液中c(HA)<c(A-),故答案为:<;
(2)二者混合时溶液体积增大一倍,浓度降为原来的一半,任何电解质溶液中都存在物料守恒,根据物料守恒得c(HA)+c(A-)=0.1mol/L,故答案为:=;
(3)酸或碱抑制水电离,含有弱离子的盐促进水电离,所以HA抑制水电离、混合溶液促进水电离,则混合后由水电离出的c(OH-)>0.2mol/L HA溶液由水电离出的c(H+),故答案为:>.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析判断能力,正确判断HA电解质强弱是解本题关键,注意物料守恒的灵活运用,知道水电离影响因素,题目难度不大.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 铜片浸入氯化铁溶液中:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 一小块钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 稀盐酸滴入硝酸银溶液中:Ag++Cl-═AgCl↓ | |
| D. | 烧碱溶液吸收氯气:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
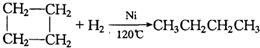
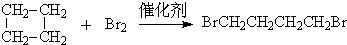 、
、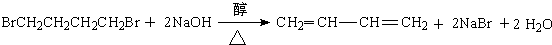 .
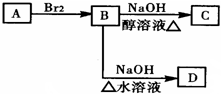
.
 ;C
;C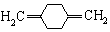 .
.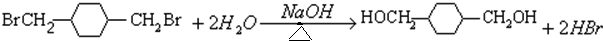 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
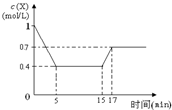 一定条件下,向密闭容器中加入1mol/L X发生反应:3X(g)?Y(g)+Z(g)△H<0,反应到5min时达到平衡,在15min时改变某一条件,到17min时又建立新平衡,X的物质的量浓度变化如图,下列说法中不正确的是( )
一定条件下,向密闭容器中加入1mol/L X发生反应:3X(g)?Y(g)+Z(g)△H<0,反应到5min时达到平衡,在15min时改变某一条件,到17min时又建立新平衡,X的物质的量浓度变化如图,下列说法中不正确的是( )| A. | 0~5 min时,该反应的速率为v(X)=0.12 mol/(L•min) | |
| B. | 15 min时改变的条件可能是减小压强 | |
| C. | 15 min时改变的条件可能是升高温度 | |
| D. | 从初始到17 min时,X的转化率为30% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH与氢氧化钠溶液反应:H++OH-=H2O | |
| B. | 氯气与氢氧化钠溶液反应:Cl2+2OH-=Cl-+ClO-+H2O | |
| C. | 金属钠与水反应:Na+H2O=Na++OH-+H2↑ | |
| D. | 氢氧化钠溶液吸收过量的二氧化碳:2OH-+CO2=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②⑦ | B. | 只有①⑦ | C. | 只有⑦ | D. | 只有①⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液中加入稀盐酸:HCO3-+H+═H2O+CO2↑ | |
| B. | 向漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 醋酸与氨水反应:CH3COOH+NH3•H2O═CH3COO-+NH4++H2O | |
| D. | 常温下,用氢氧化钠溶液吸收多余的氯气:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
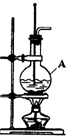 在实验室制取乙烯的装置图(如图)中,
在实验室制取乙烯的装置图(如图)中,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com