
| A.该元素最高价氧化物既能与酸反应,又能与碱反应,故称该氧化物为两性氧化物 |
| B.该元素在自然界中只以化合态存在 |
| C.该元素单质常用作半导体材料 |
| D.甲烷比该元素的气态氢化物稳定 |
科目:高中化学 来源:不详 题型:单选题
| A.道尔顿——电子轨道理论 | B.卢瑟福——量子力学模型 |
| C.玻尔——行星绕太阳模型 | D.汤姆逊——葡萄干面包模型 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。用化学用语回答下列问题:
在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。用化学用语回答下列问题: 种新型无机非金属材料,其化学式是 。
种新型无机非金属材料,其化学式是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
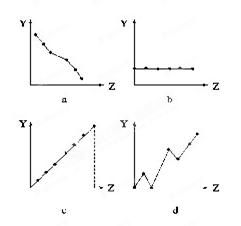
 元素有关的性质相符的曲线标号填入相应的空格中:
元素有关的性质相符的曲线标号填入相应的空格中:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 学原理相
学原理相 同
同 s多4个
s多4个 质子
质子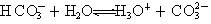
 的非金属性逐渐减弱,故氢卤酸的酸性依次减弱
的非金属性逐渐减弱,故氢卤酸的酸性依次减弱 2NH3
2NH3 (g) △H=-38.6kJ·mol-1
(g) △H=-38.6kJ·mol-1| A.全部 | B.④⑤ | C.②③④⑦ | D.②④⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 天然气。
天然气。 )是核裂变产物之一。
)是核裂变产物之一。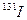 原子核内有53个质子,78个中子,关于
原子核内有53个质子,78个中子,关于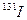 ,下列说法正确的是__________(填序号)。
,下列说法正确的是__________(填序号)。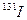 原子核外电子数为78 ②
原子核外电子数为78 ②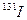 的相对原子质量约为131
的相对原子质量约为131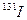 一旦被人体吸入会引发甲状腺疾病。服用含碘元素的物质可封闭甲状腺,让放射性碘无法“入侵”。我国规
一旦被人体吸入会引发甲状腺疾病。服用含碘元素的物质可封闭甲状腺,让放射性碘无法“入侵”。我国规 定在食盐中添加碘元素的标准为20-40mg/kg,若要达到防御
定在食盐中添加碘元素的标准为20-40mg/kg,若要达到防御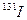 辐射的作用,一次需补充碘元素100mg。按每人每天食用10g加碘盐,则我们每天最多能从碘盐中吸收 ______ mg碘元素。
辐射的作用,一次需补充碘元素100mg。按每人每天食用10g加碘盐,则我们每天最多能从碘盐中吸收 ______ mg碘元素。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| X | | Y |
| | Z | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| ① | | | | | | | | | | | | | | | | | |
| | ② | | | | | | | | | | | | ③ | | | | |
| | ④ | | | | | | | | | | | ⑤ | | ⑥ | | ⑦ | |
| | ⑧ | | | | | | | |  | ⑨ | | | | | | | |
 。
。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com