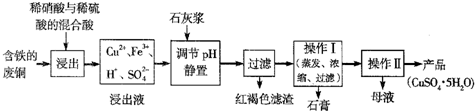
CuSO
4?5H
2O是铜的重要化合物,有着广泛的应用.以下是CuSO
4?5H
2O的实验室制备流程图.
根据题意完成下列填空:
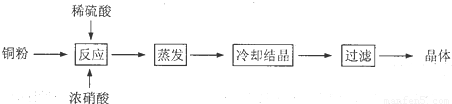
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象:______、______.
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO
4?5H
2O中可能存在的杂质是______,除去这种杂质的实验操作称为______.
(3)已知:CuSO
4+2NaOH=Cu(OH)
2↓+Na
2SO
4称取0.1000g提纯后的CuSO
4?5H
2O试样于锥形瓶中,加入0.1000mol/L氢氧化钠溶液28.00mL,反应完全后,过量的氢氧化钠用0.1000mol/L盐酸滴定至终点,耗用盐酸20.16mL,则0.1000g该试样中含CuSO
4?5H
2O______g.
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用______.在滴定中,准确读数应该是滴定管上蓝线______所对应的刻度.
(5)如果采用重量法测定CuSO
4?5H
2O的含量,完成下列步骤:①______②加水溶解③加氯化钡溶液,沉淀④过滤(其余步骤省略)在过滤前,需要检验是否沉淀完全,其操作是______
(6)如果1.040g提纯后的试样中含CuSO
4?5H
2O的准确值为1.015g,而实验测定结果是l.000g 测定的相对误差为______.


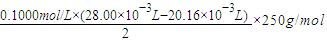 ═0.0980g,故答案为:0.0980g;
═0.0980g,故答案为:0.0980g;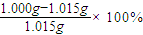 ═-1.48%,故答案为:-1.5%(-1.48%).
═-1.48%,故答案为:-1.5%(-1.48%).

 阅读快车系列答案
阅读快车系列答案