
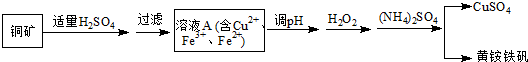
分析 铜矿与硫酸反应得到硫酸铜,过滤除去不溶物,滤液中含有Cu2+、Fe2+、Fe3+,调节溶液pH、加入过氧化氢将Fe2+氧化为Fe3+,再加入硫酸铵得到硫酸铜与黄铵铁矾.
(1)改写成氧化物时注意元素原子数目之比不变;Cu2(OH)2CO3与稀H2SO4反应生成CuSO4、二氧化碳与水,由守恒可知n(H2SO4)=n(H2SO4)=2n[Cu2(OH)2CO3]
(2)用盐酸溶解分成两等份,向一份中加入足量NaOH溶液并加热生成气体为氨气,得到沉淀为氢氧化铁,灼烧得到红色粉末为氧化铁,向另一份中加足量BaCl2溶液充分反应后,过滤、洗涤、干燥得沉淀1.165g为硫酸钡,计算氨气、氧化铁、硫酸钡物质的量,根据守恒计算n(NH4+)、n(Fe3+)、n(SO42-),再根据电荷守恒计算 n(OH-).
解答 解:铜矿与硫酸反应得到硫酸铜,过滤除去不溶物,滤液中含有Cu2+、Fe2+、Fe3+,调节溶液pH、加入过氧化氢将Fe2+氧化为Fe3+,再加入硫酸铵得到硫酸铜与黄铵铁矾.
(1)Cu2(OH)2CO3改写成氧化物形式为:2CuO•H2O•CO2,Cu2(OH)2CO3与稀H2SO4反应生成CuSO4、二氧化碳与水,由守恒可知n(H2SO4)=n(H2SO4)=2n[Cu2(OH)2CO3]=2mol,
故答案为:2CuO•H2O•CO2;2mol;
(2)用盐酸溶解分成两等份,向一份中加入足量NaOH溶液并加热生成气体为氨气,得到沉淀为氢氧化铁,灼烧得到红色粉末为氧化铁,向另一份中加足量BaCl2溶液充分反应后,过滤、洗涤、干燥得沉淀1.165g为硫酸钡,
氨气为$\frac{0.056L}{22.4L/mol}$=0.0025mol,则n(NH4+)=0.0025 mol,
氧化铁物质的量为$\frac{0.6g}{160g/mol}$=0.00375mol,则n(Fe3+)=2×0.00375mol=0.0075 mol,
硫酸钡物质的量为$\frac{1.165g}{233g}$=0.005mol,则n(SO42-)=0.005 mol,
由电荷守恒,则n(OH-)=0.0025mol+0.0075mol×3-0.005mol×2=0.015 mol,
①黄铵铁矾中NH4+与SO42-的个数比为0.0025mol:0.005mol=1:2,
故答案为:1:2;.
②黄铵铁矾中n(NH4+):n(Fe3+):n(SO42-):n(OH-)=0.0025mol:0.0075mol:0.005mol:0.015 mol=1:3:2:6,故黄铵铁矾的化学式为:NH4Fe3(SO4)2(OH)6,
故答案为:NH4Fe3(SO4)2(OH)6.
点评 本题考查物质制备与组成测定,关键是明确反应原理,(2)中关键是利用电荷守恒氢氧根离子的物质的量是,难度中等.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| A. | N2+3Mg$\frac{\underline{\;点燃\;}}{\;}$Mg3N2 | B. | N2+3H2$?_{催化剂}^{高温、高压}$2NH3 | ||
| C. | 2NO+O2═2NO2 | D. | N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
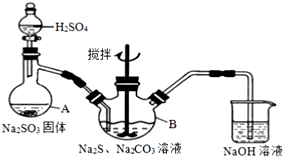 硫代硫酸钠(Na2S2O3)是一种重要的化工产品.某兴趣小组在查阅资料后制备Na2S2O3,结合其性质进行了实验探究.
硫代硫酸钠(Na2S2O3)是一种重要的化工产品.某兴趣小组在查阅资料后制备Na2S2O3,结合其性质进行了实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步骤 | 实验操作 | 实验现象及数据 |
| ① | 取wgM粉末溶于过量的盐酸 | 产生气体X在标准状况下的体积为224mL,并得到无色溶液 |
| ② | 向步骤①所得的溶液中滴加氨水,调节pH至6,过滤、洗涤、灼烧、称重 | 固体Y的质量为1.020g |
| ③ | 向步骤②所得的滤液中滴加氢氧化钠溶液,调节pH至12,过滤、洗涤、灼烧、称重 | 固体Z的质量为1.200g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | Na2O2 | C. | Na2SO4 | D. | SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COONa溶液中CH3COO-和Na+的数目 | |
| B. | 纯水在80℃和25℃时的pH | |
| C. | 相同温度下,100mL0.01mol•L-1醋酸与10mL0.1mol•L-1醋酸中H+的物质的量 | |
| D. | 相同温度下,pH=12的NaOH溶液和Na2CO3溶液中由水电离出的c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠既是氧化剂又是还原剂 | |
| B. | 3摩尔过氧化钠发生反应,有12摩尔电子转移 | |
| C. | 在高铁酸钠中铁为+4价,具有强氧化性,能消毒杀菌 | |
| D. | 高铁酸钠既是氧化产物又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
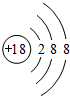
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com