


科目:高中化学 来源: 题型:
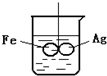 如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )
如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )| A、铁圈和银圈左右摇摆不定 |
| B、保持平衡状态 |
| C、铁圈向下倾斜,银圈向上倾斜 |
| D、银圈向下倾斜,铁圈向上倾斜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
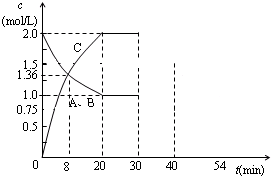 Ⅰ、某容积不变的密闭容器中充入等物质的量的气体A和B,某温度下发生反应:
Ⅰ、某容积不变的密闭容器中充入等物质的量的气体A和B,某温度下发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:
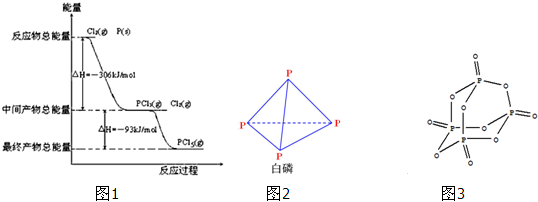
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/(kJ?mol-1) | 198 | 360 | 498 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
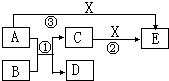 中学化学常见的物质A、B、C、D、E、X有如图所示转化关系.已知A、D是单质,B为氧化物,反应①在高温下发生.
中学化学常见的物质A、B、C、D、E、X有如图所示转化关系.已知A、D是单质,B为氧化物,反应①在高温下发生.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、固体电解质中O2-向正极移动,向外电路释放电子的电极是负极 |
| B、这个电池负极发生的反应是:C4H10+13O2--26e-═4CO2+5H2O |
| C、这种电池放电时发生的化学反应方程式为:2C4H10+13O2═8CO2+10H2O |
| D、人们追求燃料电池氧化汽油,而不在内燃机里燃烧汽油产生动力的主要原因是燃料电池具有较高的能量利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、全部 | B、只有① |
| C、只有①② | D、只有①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com