
| A. | 海带灼烧灰化,选用①②⑧ | B. | 加水浸泡加热,选用②④⑦ | ||
| C. | 过滤得到滤液,选用④⑤⑦ | D. | 萃取和分液,选用③④⑥ |
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| B. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH${\;}_{4}^{+}$ | |
| C. | 将NaHSO4与Ba(OH)2溶液混合至中性:H++SO42-+Ba2++2OH-═BaSO4↓+H2O | |
| D. | 向氨水通入足量SO2:SO2+2NH3•H2O=2NH4++SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活化能的大小对化学反应前后的能量变化不产生影响 | |
| B. | 化学键的断裂和形成是物质在化学变化中发生能量变化的主要原因 | |
| C. | 盐酸和NaOH(aq)反应的中和热△H=-57.3kJ/mol,则H2SO4(aq)和Ca(OH)2(aq)反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | CO(g)的燃烧热是283.0kJ/mol,则反应2CO2(g)=2CO(g)+O2(g)的反应热△H=+2 x283.0kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 2:11 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
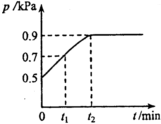 在1.0L密闭容器中放入0.10mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )
在1.0L密闭容器中放入0.10mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )| A. | 从反应开始到t1时的平均反应速率v(X)=$\frac{0.04}{{t}_{1}}$mol(L•min) | |
| B. | 该温度下此反应的平衡常数K=$\frac{0.32}{{t}_{2}}$ | |
| C. | 欲提高平衡体系中Y的含量,可降低体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.10 mol气体X,平衡正向移动,X的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +244.1 kJ•mol-1 | B. | -488.3 kJ•mol-1 | C. | -996.6 kJ•mol-1 | D. | +996.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaCl(aq)+AgNO3(aq)=AgCl(s)+NaNO3(aq )△H<0 | |
| B. | 2KMnO4(s)=2K2MnO4(s)+MnO2(s)+O2(g)△H>0 | |
| C. | 2FeCl3(aq)+Fe(s)=3FeCl3(aq)△H<0 | |
| D. | 2H2(g)+O2(g)=2H2O (l)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
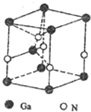 碳、氮元素及其化合物在生产、生活和科学研究等方面有着重要的作用研究它们的结构与性质意义重大.请回答下列有关问题:
碳、氮元素及其化合物在生产、生活和科学研究等方面有着重要的作用研究它们的结构与性质意义重大.请回答下列有关问题: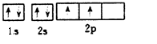 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
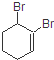 的系统命名的名称是( )
的系统命名的名称是( )| A. | 1,2-二溴-2-环己烯 | B. | 1,2-二溴-1-环己烯 | ||
| C. | 1,6-二溴-1-环己烯 | D. | 2,3-二溴-1-环己烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com