
【题目】下列有关物质性质与用途具有对应关系的是( )
A. 浓硫酸具有吸水性,可用于干燥O2
B. SO2具有氧化性,可用于漂白纸浆
C. Fe2O3能与酸反应,可用于制作红色涂料
D. Al(OH)3能与盐酸反应,可用于治疗胃酸过多
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 碱性锌锰电池是二次电池
B. 铅蓄电池是二次电池
C. 二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生
D. 燃料电池的活性物质没有储存在电池内部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中能大量共存的是( )
A.酸性溶液中:Na+、Cl﹣、OH﹣、CO32﹣
B.碱性溶液中:Fe3+、NH4+、HCO3﹣、Cl﹣
C.无色溶液中:Na+、Cu2+、MnO4﹣、I﹣
D.透明溶液中:Na+、Fe3+、Cl﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 100g 46%的乙醇溶液中,含H-O键的数目为NA
B. 1molNaHSO4在熔融状态下电离出的阳离子数为2NA
C. 氢氧燃料电池负极消耗1.12L气体时,电路中转移的电子数为0.1NA
D. 常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3、NaHCO3是生活中常见的盐,某实验小组通过以下实验了探究这两种物质的性质。
(1)称取两种固体各1g分别放入两支试管中,再各加入5mL水,充分振荡,并恢复至室温。发现Na2CO3完全溶解,而NaHCO3有剩余。由此得出结论:在相同温度下,________。
(2)①取少量NaHCO3按下图装置进行实验。可观察到的现象是:大试管口有水珠生成,____________。

②用______________的方法除去混在Na2CO3粉末中少量的NaHCO3。
(3)测定Na2CO3样品(含氯化钠杂质)中Na2CO3的质量分数:
①称取mg样品放入烧杯内加水溶解。
②加入过量的氯化钙溶液充分反应,反应的化学方程式为_________________。
③过滤、洗涤、干燥,称量沉淀的质量为ng。则样品中Na2CO3的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关焰色反应实验操作注意事项的说法中正确的是( )
①钾的火焰颜色要透过蓝色钴玻璃观察
②先将铂丝灼烧到与原来火焰的颜色相同,再蘸取被检验的物质
③每次实验后,要将铂丝用盐酸洗净
④钡的焰色反应为黄绿色
⑤没有铂丝时,也可以用玻璃棒代替
A.仅有③不正确B.仅有④不正确C.仅有⑤不正确D.全对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像均为实验过程中产生沉淀的物质的量与加入试剂的量之间的关系图,其中错误的是


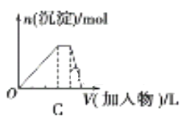

A. 图A表示向MgCl2、AlCl3和盐酸的混合溶液中逐滴滴入NaOH溶液至过量
B. 图B表示将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系
C. 图C表示向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量
D. 图D表示向烧碱溶液中滴加明矾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一.运用铁及其化合物的知识,完成下列问题.
Ⅰ.(1)所含铁元素既有氧化性又有还原性的物质是_______(用字母代号填).
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)取一定量氯化亚铁固体,配制成0.1 mol/L 的溶液。检验亚铁离子是否被氧化的方法:______________________________________________。
Ⅱ.工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等)制备绿矾FeSO4·7H2O的流程如下:
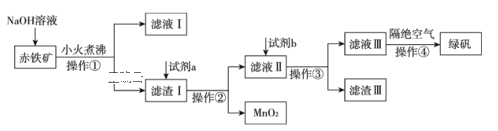
(1)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为____________;_________________。
(2)向滤渣Ⅰ中加入过量的试剂a为___________,过量的试剂b投入到滤液Ⅱ发生的所有反应的离子方程式为______________;_________________;________________。
(3)实验室中操作①②③的名称为_________________________。
(4)操作④隔绝空气的目的是_______________________________________________。
Ⅲ. 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中Na2O2 是________(填氧化剂、还原剂),与CO2反应的化学反应方程式_________________________。
(2)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:___________________________________________________________。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近在-100℃的低温下合成了一种烃X,X分子中所有氢原子的化学环境没有区别,其球棍模型如图。下列说法中不正确的是

A. X的分子式为C5H4
B. X分子中有碳碳单键,也有碳碳双键
C. 该烃X与等质量的甲烷相比,X燃烧时消耗的氧气更多
D. X分子中的氢原子分布在两个相互垂直的异面直线上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com