
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | CH3CH2OH (CH3COOH) | CaO | 蒸馏 |
| D | CH3COOC2H5 (CH3COOH) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
科目:高中化学 来源: 题型:选择题
| A. | 钠块在氯气中燃烧,产生白烟 | |
| B. | 将氯水滴入紫色石蕊试液中,试液先变红后褪色 | |
| C. | 用pH试纸测得0.1mol•L-1硫酸铝溶液显中性 | |
| D. | 向新切土豆上滴加碘水,土豆片上显示蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤ | B. | ①③④ | C. | ④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
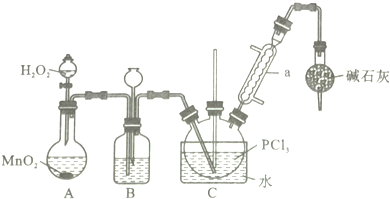
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
| PCl3 | -112.0 | 76.0 | 137.5 | 均为无色液体,遇水均剧烈水解为含氧酸和氯化氢,两者互溶 |
| POCl3 | 2.0 | 106.0 | 153.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下与足量18mol/LH2SO4反应,最多可放出0.6molH2 | |
| B. | 常温下与足量2mol/LHNO3反应,最少可放出0.45molH2 | |
| C. | 常温下与足量2mol/LH2SO4反应,放出H2的量在0.45mol~0.6mol之间 | |
| D. | 常温下与足量2mol/LNaOH反应,放出H2的量在0.45mol~0.6mol之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
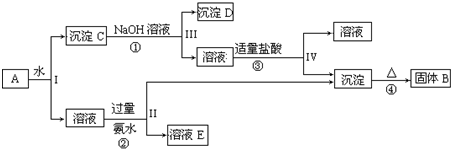
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
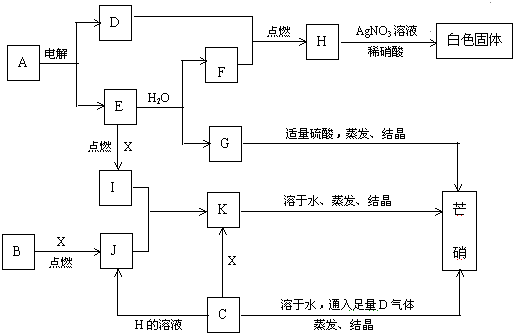
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com